使用者:Jdysw/全血細胞計數
| 全血細胞計數 | |
|---|---|
 全血細胞計數樣本和檢測結果列印件 | |
| MeSH | D001772 |
| MedlinePlus | 003642 |
| LOINC | Codes for CBC |
全血細胞計數(英語:complete blood count,CBC),也可稱為血細胞常規檢驗、血常規、血細胞分析、血象[1],是一種臨床常規檢測項目,用於評估血液中白血球、紅血球和血小板三類血細胞的數量和形態特徵,主要涉及紅血球計數、紅血球指數、白血球計數、血小板計數、血紅蛋白濃度、血細胞比容等指標。通常全血細胞計數還包含用於分析各類白血球比例分布的白血球分類計數。
全血細胞計數的檢測結果既可用於健康狀態監測,也可作為疾病診斷依據。檢測結果需對照參考值範圍(受性別與年齡差異影響)進行分析。其異常指標可以幫助診斷部分疾病,如貧血、血小板減少症。其中,紅血球指數能提示貧血病因(如缺鐵性貧血與維生素 B12 缺乏型貧血);白血球分類計數則有助於輔助診斷病毒感染、細菌感染、寄生蟲感染還是白血病等血液系統疾病。不過並非所有超出參考值範圍的檢測值都需要醫學干預。
在當代,全血細胞計數主要使用全自動血細胞分析儀進行檢測,該儀器可計數各類血細胞並收集其大小、結構等形態學信息。在檢測時,血細胞分析儀能夠測定血紅蛋白濃度,並基於紅血球計數和血紅蛋白測定值自動計算紅血球指數。當檢測結果異常時,需採用人工鏡檢方法進行復檢。據統計,約10-25%的樣本需要進行人工血塗片檢查。在人工檢查時,樣本會被染色並放在顯微鏡下觀察,以檢驗儀器檢測結果是否無誤並查找異常。在缺乏自動化設備的實驗室中,血細胞比容可通過離心樣本後測定紅血球比例獲得,血細胞計數則需藉助血細胞計數板在顯微鏡下人工完成。
全血細胞計數技術的發展經歷了多個階段。1852年,卡爾·維爾羅德發明了首個血細胞計數方法,該方法通過將定量血液塗布於顯微鏡載玻片後進行人工計數。1874年,路易-夏爾·馬拉色發明的血細胞計數器簡化了顯微鏡分析血細胞方法。至19世紀末,保羅·埃爾利希與德米特里·列昂尼多維奇·羅曼諾夫斯基發明了白血球和紅血球染色技術,這些技術至今仍廣泛應用於血塗片檢查中。20世紀20年代,血紅蛋白自動測定方法問世;1929年,麥克斯韋·溫特羅布提出了血細胞比容測定法,並定義了紅血球指數。1953年華萊士·H·庫爾特提出的庫爾特原理使得血細胞計數自動化進程取得突破性進展,該技術利用電阻抗測量實現血細胞計數和大小測定,至今仍是眾多自動化血細胞分析儀的核心技術。20世紀70年代,基於光學測量的細胞計數與識別技術的研究進展推動了白血球分類計數自動化的發展。
檢測目的
[編輯]
血液由血漿和血細胞(紅血球、白血球和血小板[註 1]組成[3]。血細胞計數的顯著異常(升高或降低)可以直接幫助診斷某些疾病(如貧血、血小板減少症)[4]。即使不能直接揭示病因,許多器官系統的變化都可能會影響到血液成分的變化,這種變化不僅包括細胞計數與分類的變化,也通常伴隨著細胞形態的改變[5]。而全血細胞計數的檢測結果可以反映這三類血細胞的數量、比例分布和形態學差異,因此全血細胞計數檢測結果在疾病篩查和鑑別診斷中具有重要臨床價值,提供諸多重要信息,它已成為最常進行的醫學實驗室檢測項目之一[6][7][8]。
全血細胞計數是疾病篩查的重要工具[9]。當臨床醫師懷疑患者存在影響血細胞的疾病(如感染、出血性疾病或某些癌症)時,需要進行全血細胞計數以確認患者血液系統的狀態,及早發現病情[5]。對於已確診導致全血細胞計數指標異常的患者,或正在接受可能影響血細胞計數的治療的患者,需定期進行全血細胞計數以監測病情變化[10][11],並且通常每天對住院患者進行該檢測[12],根據檢測結果判斷是否需要輸血[13]。
全血細胞計數在各醫學專科都有特定的應用。在患者接受手術前,全血細胞計數用於篩查貧血、評估血小板水平、檢測潛在感染[12][14];術後則用於監測失血情況和血液成分變化[9][15]。在急診醫學中,全血細胞計數能幫助醫生評估發燒、腹痛、呼吸急促等非特異性症狀,以迅速探明病因[16][17][18],同時還可以用於確認病人出血和創傷程度[19][20]。對於接受放療或化療的腫瘤患者,由於這些治療手段會抑制骨髓造血功能,並可能導致白血球、血小板和血紅蛋白水平顯著降低,因此需要密切監測血細胞計數[21]。服用某些精神藥物(如氯氮平、卡馬西平)的患者需定期接受全血細胞計數檢測,在極少數情況下,這些藥物可能會導致危及生命的白血球數量下降(粒細胞缺乏症)[22][23]。在產科中,全血細胞計數作為產前常規檢查項目可及時發現妊娠期貧血,預防母嬰不良結局[24][24];在嬰兒出生後,則可通過全血細胞計數判斷黃疸或檢測白血球中未成熟細胞數量,輔助診斷新生兒膿毒症[25][26]。
血液學研究與血液相關的疾病的病因、預後、治療和預防,因此全血細胞計數也是血液學的重要工具。全血細胞計數與血塗片檢查能夠全面反映造血系統(即參與血細胞生成和發育的器官和組織),特別是骨髓的狀態[6][27]。例如,三種血細胞指數均偏低時(全血細胞減少症)表明可能有疾病引發了骨髓造血功能障礙,需進一步進行骨髓檢查明確病因[28]。血塗片中出現的異常細胞可為急性白血病或淋巴瘤的診斷提供重要線索[27]。當中性粒細胞或淋巴細胞計數顯著升高,結合臨床表現和血塗片特徵,可能暗示為骨髓增殖性疾病或淋巴增殖性疾病。此外通過綜合分析全血細胞計數結果和血塗片特徵,還可有效鑑別貧血的真正病因,包括營養性缺乏性貧血、骨髓疾病、獲得性溶血性貧血以及鐮狀細胞貧血和地中海貧血等遺傳性疾病[29][30]。
檢測方式與檢測原理
[編輯]樣本採集需使用含抗凝劑(通常為EDTA)的真空採血管,以防止血液自然凝固[31]。採血通常採用靜脈穿刺法,但在靜脈採血困難時,也可採用末梢採血,從成人指尖或新生兒足跟的毛細血管中採血[32][33],一般而言靜脈血樣本的檢測結果較末梢血樣本更為準確全面[5]。目前全血細胞計數檢測主要使用全自動血細胞分析儀,當出現計數異常、散點圖直方圖異常、儀器報警等異常結果時,需使用血塗片鏡檢或人工血細胞比容測定進行人工復檢[34]。在缺乏自動化分析設備的實驗室中,血細胞計數和血紅蛋白測定也可人工測定完成[35]。
全自動血細胞分析儀檢測
[編輯]在使用血細胞分析儀檢測時,樣本首先需經過充分混勻以確保細胞均勻分布,隨後在被稀釋後分配至至少兩個檢測通道中,其中一個檢測通道用於紅血球和血小板計數,而另一個檢測通道用於白血球計數和血紅蛋白測定。部分儀器會使用專門通道用於血紅蛋白測定,其他通道專用於白血球分類計數、網織紅血球計數和血小板檢測[36][37][38]。檢測過程中,細胞懸浮液在流體動力作用下通過傳感器,通過流式細胞術精確測量物理形態[註 2][39][41]。為提高檢測準確性,現代血細胞分析儀採用流體動力學聚焦技術,將稀釋樣本注入鞘液,利用層流使細胞呈單列排列依次通過檢測區,從而實現單個細胞的精準檢測[42][43]。


血紅蛋白濃度的測定需在獨立於紅血球計數通道的專用通道中進行。首先向測試樣本加入試劑,使紅血球裂解釋放其胞內的血紅蛋白。在部分血細胞分析儀中,血紅蛋白測定與白血球計數共用於同一通道,這種設計使白血球計數更為容易[44]。血細胞分析儀的檢測原理基於分光光度法,具體而言就是利用血紅蛋白濃度與吸光度之間的線性關係進行血紅蛋白濃度分析。檢測過程中,試劑將氧合血紅蛋白、碳氧血紅蛋白等不同血紅蛋白形式轉化為更為穩定的形式(通常為氰化高鐵血紅蛋白),並發生顯色反應。隨後使用特定波長(通常為540納米)測定顯色溶液的吸光度,即可準確計算血紅蛋白濃度[45]。
血細胞分析儀傳感器主要利用電阻抗和光散射兩種原理實現細胞識別與計數[46]。電阻抗原理又被稱為庫爾特原理,具體來講就是將細胞懸浮於帶電液體中,當細胞通過小孔時,由於其導電性低,會導致電流瞬時下降,而細胞通過小孔時產生的電脈衝幅度與細胞體積成正比,由此脈衝數則反映了樣本中的細胞數量[47][48]。通過繪製細胞體積分布直方圖,並依據不同細胞類型的典型體積設置閾值,即可實現各類細胞的識別與計數[49]。
光散射技術利用雷射或鎢鹵燈光源照射細胞,當細胞通過光束時以不同的角度散射光,隨後利用光度計通過檢測散射光獲取細胞大小和結構信息[50]。其中,前向散射光主要源於光的衍射效應,其強度與細胞大小呈正相關;而側向散射光則由光的反射和折射產生,可反映細胞內部結構的複雜程度[50][51]。
基於射頻的檢測方法可與阻抗技術聯合使用。該技術雖然同樣基於細胞通過小孔時引起的電流變化進行檢測,但由於高頻射頻電流能夠穿透細胞膜,其產生的脈衝幅度可反映細胞核的大小、結構和細胞質中顆粒數量等信息[52][53]。在血小板計數中,與血小板大小相似的小紅血球和細胞碎片可能造成干擾,而大血小板則易被漏檢。為此,一些血細胞分析儀還採用如螢光染色、多角度光散射和單株抗體標記等技術提高血小板計數的準確性[38]。
大多數血細胞分析儀直接測量出平均紅血球體積,隨後通過紅血球計數與平均紅血球體積的乘積計算血細胞比容;一些血細胞分析儀也通過紅血球總體積與樣本體積之比測定血細胞比容,再結合紅血球計數推算平均紅血球體積。基於血紅蛋白濃度、紅血球計數和血細胞比容三個基本參數,可進一步計算平均紅血球血紅蛋白含量和平均紅血球血紅蛋白濃度。此外,通過分析平均紅血球體積標準差得出的紅血球分布寬度,可反映紅血球體積的異質性[54]。

經試劑處理後,當白血球的體積繪製在直方圖上時,會形成三個明顯的峰。這些峰大致對應粒細胞、淋巴細胞和其他單核細胞,從而僅基於細胞體積即可進行三分類計數[55][56]。更先進的血細胞分析儀通過聯合使用光散射、射頻分析等技術[56],或採用特異性染料標記細胞內化學物質(如未成熟細胞中濃度較高的核酸[57]或髓系細胞特有的髓過氧化物酶[58]),可實現五分類甚至七分類計數。其中,嗜鹼性粒細胞的檢測通常在專用通道中進行,在該通道中試劑會破壞其他白血球而保留嗜鹼性粒細胞。檢測數據經分析後生成散點圖,形成與各類白血球對應的特徵性點簇[56]。此外,另一種基於人工智慧的數字顯微鏡系統可實現自動化分類計數[59],該系統通過分析血塗片顯微圖像進行細胞分類,並將分類結果呈現給操作人員以供復檢和必要的人工分類[60]。
大多數血細胞分析儀可在不到一分鐘內完成全血細胞計數的所有檢測項目[46]。由於採用對大量單個細胞進行採樣和計數的原理,檢測結果具有極高的精確性。然而,對於某些形態異常的細胞,儀器可能無法準確識別,此時需通過人工鏡檢復檢,並採用其他檢測方法對儀器無法分類的異常細胞進行鑑定[61]。
即時檢測
[編輯]即時檢測是指在患者床邊或診所等實驗室外場合進行的檢測[62][63]。與實驗室檢測相比,即時檢測具有檢測速度快、樣本需求量少、人員無需專門培訓等優勢,特別適用於急診救治和醫療資源匱乏地區。常用的即時血液檢測設備包括採用分光光度法測定血紅蛋白濃度的可攜式血紅蛋白計,以及通過血液電導率估算紅血球濃度來測定血紅蛋白的i-STAT系統[63]。雖然血紅蛋白和血細胞比容可以在用於血氣測試的即時測量設備上檢測,但其準確性有所欠佳[62]。另外也有一些專為診所設計的簡化版血液分析儀可提供全血細胞計數及分類計數等基本檢測項目[64]。
人工檢測
[編輯]
在缺少血細胞分析儀或檢測結果需復檢時,可採用人工檢測方法[35]。約10-25%的情況,自動檢測結果會被標記需進行人工血塗片復檢,主要原因包括:分析儀無法準確識別的異常細胞群體、儀器質控標誌提示結果可靠性存疑[65],或檢測值超出預設參考值範圍[61]。人工復檢時,需將血液樣本塗布於載玻片上,用羅氏染液染色後鏡檢[66]。鏡檢內容包括評估紅血球、白血球及血小板的形態特徵,並記錄所有異常項目[67]。其中,紅血球形態改變具有重要診斷價值,例如鐮狀紅血球提示著鐮狀細胞病,而大量裂紅血球的出現則需排查微血管病性溶血性貧血[68]。此外,在某些發炎和多發性骨髓瘤等骨髓瘤蛋白疾病患者中,血漿蛋白水平升高可導致紅血球疊連[69]。某些血液寄生蟲疾病(如瘧疾、巴貝蟲病)可通過血塗片直接檢出病原體[70]。當自動血小板計數結果不準確時,血塗片鏡檢還可用於血小板計數[61]。
人工白血球分類計數需由檢驗人員在血塗片上計數100-200個白血球,依據細胞形態特徵進行分類[71]。這樣就得到了各類白血球所占百分比,再將其乘以白血球總數,即可獲得各類白血球的絕對計數值[72]。因計數細胞數量遠少於儀器分析,人工計數方法容易受到抽樣誤差的影響,但它可以識別儀器無法分辨的異常細胞[61],如急性白血病患者血液中的前體細胞[73]。此外,通過顯微鏡檢查還能發現如中毒顆粒和空洞形成等具有重要臨床意義的細胞形態特徵改變[74]。
人工測定血細胞比容可採用毛細管法,將抗凝全血注入毛細管,經離心後直接測量紅血球柱所占百分比,該百分比即是血細胞比容。在一些情況下,儀器檢測結果可能受到干擾並不準確,如患者患有紅血球增多症(紅血球計數異常升高)或重度白血球增多症(白血球計數顯著升高,導致白血球被誤計為紅血球,從而干擾紅血球測量)時[75],此時人工測定血細胞比容方法能夠發揮很大作用。
紅血球、白血球和血小板人工計數常使用血細胞計數板。血細胞計數板是一種專用於人工細胞計數的特殊顯微鏡載玻片,其內置腔室可容納稀釋血液樣本。腔室表面刻有計數網格,樣本占據的網格數可換算為樣本體積,操作者通過計數網格內的細胞數量再除以樣本體積,即可計算出樣本中的細胞濃度[35]。與儀器分析相比,人工計數方法操作繁瑣且準確性較低,因此除缺乏相關涉筆的實驗室外,現已很少使用[35]。白血球計數需使用含可以裂解紅血球的化合物(如草酸銨、乙酸或鹽酸)的稀釋液處理樣本[76]。有時為便於識別,常在稀釋液中加入染色劑以增強白血球核的顯色效果。血小板計數方法與之類似,但部分方法會保留紅血球,此時採用相差顯微鏡可顯著提高血小板識別率[77]。紅血球人工計數因準確性欠佳而較少採用,實踐中更傾向於使用血紅蛋白測定和血細胞比容測定等替代方法;但在需要時,可使用生理鹽水稀釋血液樣本後進行紅血球計數[78]。
血紅蛋白的人工測定通常使用分光光度計或比色計。測定時,首先使用裂解試劑處理血液樣本,使紅血球破裂釋放血紅蛋白,隨後加入轉化試劑將各類血紅蛋白轉化為同一種血紅蛋白形式。再將處理後的溶液放入吸收池,在特定波長(取決於所用試劑類型)下測定吸光度。最後參照吸光度與血紅蛋白濃度關係,即可準確計算樣本的血紅蛋白濃度[79]。對於缺乏實驗室設施的偏遠地區,還可使用血紅蛋白比色卡進行簡易血紅蛋白測定,將血滴滴於測試濾紙上,等待片刻,再將濾紙顏色與比色卡對比即可估算血紅蛋白濃度[80]。
檢測內容與臨床意義
[編輯]全血細胞計數主要檢測血小板、紅血球和白血球數量,以及血紅蛋白濃度、血細胞比容值和紅血球指數。其中紅血球指數包括:平均紅血球體積、平均紅血球血紅蛋含量和平均紅血球血紅蛋白濃度與紅血球分布寬度。此外,全血細胞計數也可包括白血球分類計數與網織紅血球計數等檢測項目[11][81]。
紅血球、血紅蛋白和血細胞比容
[編輯]| 項目 | 縮寫 | 結果 | 參考值範圍 |
|---|---|---|---|
| 紅血球計數 | RBC | 5.5 x 1012/L | 4.5–5.7 |
| 白血球計數 | WBC | 9.8 x 109/L | 4.0–10.0 |
| 血紅蛋白 | HGB | 123 g/L | 133–167 |
| 血細胞比容 | HT | 0.42 | 0.35–0.53 |
| 平均紅血球體積 | MCV | 76 fL | 77–98 |
| 平均紅血球血紅蛋白含量 | MCH | 22.4 pg | 26–33 |
| 平均紅血球血紅蛋白濃度 | MCHC | 293 g/L | 330–370 |
| 紅血球分布寬度 | RDW | 14.5% | 10.3–15.3 |
紅血球通過其內含的血紅蛋白將氧氣從肺部輸送至全身組織,同時將組織代謝產生的二氧化碳帶回肺部排出[83]。自動化血細胞分析儀可精確計數紅血球與測定平均紅血球體積,單位通常為百萬細胞/微升(×106/μL)或萬億細胞/升(×1012/L)[11]。通過平均紅血球體積與紅血球計數的乘積可測定血細胞比容,單位通常為飛升(fL)或立方微米(μm3);反之,通過直接測定的血細胞比容和紅血球計數也可推算平均紅血球體積[84][85]。血紅蛋白測定需先裂解紅血球,單位為克/升(g/L)或克/分升(g/dL)[86]。在紅血球形態正常的情況下,血紅蛋白與紅血球比容存在恆定關係:紅血球比容百分比值約為血紅蛋白值(g/dL)的三倍,波動範圍在±3%內。這一關係稱為「三法則」,可用於驗證全血細胞計數檢測結果的可靠性[87]。
基於紅血球計數、血紅蛋白濃度和血細胞比容三個檢測結果,可計算出平均紅血球血紅蛋白含量和平均紅血球血紅蛋白濃度[88][89]。這兩個指標分別反映單個紅血球的血紅蛋白絕對含量和相對濃度:平均紅血球血紅蛋白含量表示每個紅血球中血紅蛋白的平均質量,而平均紅血球血紅蛋白濃度則反映紅血球內血紅蛋白的平均占比。兩者的區別在於,平均紅血球血紅蛋白濃度考慮了紅血球體積因素,而平均紅血球血紅蛋白含量則並不考慮{{}Snf|Schmaier|Lazarus|2012|p=25}。平均紅血球體積、平均紅血球血紅蛋白含量和平均紅血球血紅蛋白濃度統稱為紅血球指數[88][89]。這些指標的異常改變可通過血塗片鏡檢觀察到:與正常大小的白血球相比,可以識別出體積異常的紅血球;而血紅蛋白含量降低的細胞則顯得蒼白[90]。此外,通過上述三個檢測值還可計算出紅血球分布寬度,該指標反映了紅血球體積的異質性程度[91]。
紅血球數量異常增多可導致血紅蛋白濃度和血細胞比容升高{{注|並非總是如此。例如,在地中海貧血患者中,儘管紅血球計數升高,但由於紅血球體積顯著減小,血紅蛋白濃度可能維持在正常或偏低水平[92][93]。此時,可通過Mentzer指數(即平均紅血球體積與紅血球計數的比值)來診斷缺鐵性貧血與地中海貧血[94],這一症狀稱為紅血球增多症[95]。根據發病機制不同,紅血球增多症可分為相對性增多和絕對性增多兩類。相對性紅血球增多症常見於脫水或使用利尿劑等情況,因血漿含量減少導致紅血球相對濃度上升所致[96]。絕對性紅血球增多症則是紅血球數量本身增加,又可分為繼發性與原發性兩類。繼發性紅血球增多症通常由組織缺氧或促紅血球生成素的代償性增加有關,常見於嚴重的慢性心肺疾病、某些先天性心臟病以及異常血紅蛋白病等[96]。而原發性紅血球增多症被稱為真性紅血球增多症,是一種骨髓增殖性疾病,表現為紅血球與其他血細胞生成的過度活躍[97]。

當血紅蛋白濃度、血細胞比容或紅血球計數異常低於參考值範圍時提示患者存在貧血[98]。貧血本身不是一種獨立的疾病,而是一種反映患者紅血球異常的臨床症狀[72]。貧血的病因主要包括:失血、生成缺陷紅血球(無效造血)、紅血球生成減少(造血功能低下)和紅血球破壞增加(溶血性貧血)[99]。
通過分析紅血球指數有助於確定貧血病因。根據平均紅血球體積大小,貧血可分為小細胞性貧血(平均紅血球體積降低)和大細胞性貧血(平均紅血球體積升高);而平均紅血球血紅蛋白濃度降低則提示低色素性貧血。當患者存在貧血紅血球指數卻均處於正常範圍時,為正色素性貧血和正常細胞性貧血[90]。因平均紅血球血紅蛋白濃度高於參考上限的情況非常少見,在臨床上較少使用高色素性這一術語,平均紅血球血紅蛋白濃度高於參考上限主要發生於球形細胞增多症、鐮狀細胞病和血紅蛋白C病等疾病[89]。此外,平均紅血球血紅蛋白濃度升高也可能是某些干擾因素導致的假性檢驗結果,例如紅血球凝集(引起紅血球計數假性降低)[100][101]或高脂血症(導致血紅蛋白測定值假性升高)[102]。
小細胞性貧血通常與缺鐵性貧血、地中海貧血和慢性病性貧血相關;大細胞性貧血則多與酒精濫用、葉酸與維生素B12缺乏、特定藥物使用和某些骨髓疾病相關。正常細胞性貧血的病因包括急性失血、溶血性貧血、骨髓疾病及多種慢性疾病[89][103]。平均紅血球體積在實驗室質量控制中具有特殊用途:相較於其他全血細胞計數參數,平均紅血球體積相對穩定,因此其顯著波動可能表明患者身份混淆、樣本採集錯誤[104]。
紅血球分布寬度降低無臨床意義,但其升高表明紅血球大小異質性增加,這種症狀被稱為紅血球大小不均症[91]。紅血球大小不均症常見於營養性貧血,如缺鐵性貧血和維生素B12、葉酸缺乏引起的貧血;而地中海貧血患者的紅血球分布寬度通常正常[91]。基於全血細胞計數結果,可進一步開展針對性檢查以明確貧血病因,如鐵蛋白檢測以確認是否為缺鐵性貧血,血紅蛋白電泳則有助於鑑別診斷地中海貧血、鐮狀細胞病等血紅蛋白病[105]。
白血球
[編輯]
|
|
白血球負責防禦感染並參與發炎反應[107]。白血球計數升高(白血球增多症),常見於感染、發炎和生理應激狀態,也可能由骨髓增殖性疾病或淋巴增殖性疾病等涉及異常血細胞生成疾病引起[108]。白血球計數減少(白血球減少症)常見於放療、化療等治療後和抑制血細胞生成性疾病中[109]。不過白血球計數受個體生理性因素影響較大,部分個體還會周期性白血球減少,因此白持續性或者定點性監測的檢測結果才更有臨床意義[110]。白血球計數通常以每微升血液中的細胞數(/μL)或每升中的109細胞數(×109/L)為單位[11]。
白血球分類計數識別並計數各類白血球,結果以百分比和絕對計數(每單位體積細胞數)兩種形式呈現。白血球分類計數通常檢測中性粒細胞、淋巴細胞、單核細胞、嗜酸性粒細胞和嗜鹼性粒細胞五類白血球[11]。部分儀器還檢測未成熟粒細胞,具體包括早幼粒細胞、中幼粒細胞和晚幼粒細胞[註 3][113]。若在人工分類計數中發現其他細胞類型,也需在檢測報告中註明[114]。
白血球分類計數結果在疾病的診斷和監測中發揮著重要作用。以中性粒細胞為例,其計數升高(中性粒細胞增多症)常見於細菌感染、發炎反應與骨髓增殖性疾病[115][116];而計數降低(中性粒細胞減少症)則可能繼發於化療、特定藥物使用或骨髓疾病[117][118]。此外,某些先天性疾病也可導致中性粒細胞減少,並可能在兒童病毒或細菌感染後短暫發生[119]。對於伴有感染症狀的嚴重中性粒細胞減少患者,需及時給予抗生素治療以預防致命性併發症[120]。

桿狀核粒細胞或其他未成熟粒細胞數量增加稱為核左移,常見於膿毒症和某些血液病,但妊娠期及產褥期也會發生生理性核左移[121][122];與之相對的,中性粒細胞的分葉過多稱為核右移,常見於巨幼細胞性貧血、惡性貧血等[123]。淋巴細胞增多(淋巴細胞增多症)與病毒感染[2]和淋巴增殖性疾病(如慢性淋巴細胞白血病)有關[124];單核細胞增多(單核細胞增多症)則與慢性發炎相關[125];嗜酸性粒細胞增多(嗜酸性粒細胞增多症)常見於寄生蟲感染和過敏性疾病[126]。嗜鹼性粒細胞增多(嗜鹼性粒細胞增多症)可能提示骨髓增殖性疾病,如慢性粒細胞白血病和真性紅血球增多症[116]。原始細胞和具有腫瘤特徵的淋巴細胞等異常細胞往往提示血液系統惡性腫瘤[73][127]。
血小板
[編輯]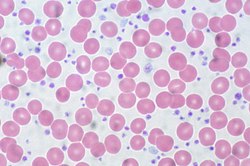
血小板在凝血過程中發揮著至關重要的作用。當血管內皮受損時,血小板會迅速粘附於損傷部位並堵塞間隙,形成初期的血小板血栓;同時,凝血級聯反應激活產生的纖維蛋白進一步加固血小板血栓,形成穩定的血凝塊[128]。正常人的血小板數相對穩定,並不會發生太大的波動,也無明顯性別和年齡差異[129]。當血小板嚴重減少(血小板減少症)時可導致出血[130],常見於接受骨髓抑制治療(如放療、化療)、服用特定藥物(如肝素),這些藥物會誘導免疫系統破壞血小板。血小板減少也是如急性白血病、再生障礙性貧血等血液病和某些自體免疫性疾病[131][132]。對於重度血小板減少患者,可能需要進行血小板輸血治療[133]。血小板增多(血小板增多症)大致可由原發性血小板增多症、反應性血小板增多症和其他伴血小板增多的血液系統疾病三類疾病引起[134]。原發性血小板增多症可導致血小板計數顯著升高[135]。反應性血小板增多症多由發炎、缺氧、創傷、缺鐵性貧血、癌症引起[135][136][129]。其他伴血小板增多的血液系統疾病包括慢性髓性白血病、慢性粒單核細胞白血病、骨髓增生異常症候群等大多數血液病[134]。檢測結果中,血小板計數通常以細胞數/微升(/μL)、103細胞數/微升(× 103/μL)或10^9細胞數/升((× 109/L))為單位[11]。
平均血小板體積衡量血小板平均大小,單位為飛升(fL),可以幫助確認血小板減少症的病因。當血小板破壞增加導致新生血小板補償釋放時,平均血小板體積通常升高;而骨髓功能障礙引起的血小板生成減少則可能導致平均血小板體積降低。此外,平均血小板體積還可用於鑑別遺傳性血小板減少症[91][137]。部分血細胞分析儀可檢測未成熟血小板比例(IPF)和網織血小板計數,通過未成熟血小板數量計算血小板生成速率[138]。
其他檢測內容
[編輯]網織紅血球計數
[編輯]
網織紅血球是介於晚幼紅血球與成熟紅血球之間的未成熟紅血球,細胞質內還殘存著部分RNA[139],主要用於貧血病因診斷和治療效果評估。在大多數情況下,網織紅血球與骨髓生成紅血球正相關[139]。網織紅血球計數高提示骨髓正以高速率產生紅血球以補償失血或溶血[140];而網織紅血球減少則提示造血功能低下,患者可能患有降低紅血球生成能力的疾病[141]。在營養性貧血治療中,網織紅血球計數的升高反映了營養補充治療手段效果良好[140]。血細胞分析儀使用RNA特異性染料染色,再通過光散射或螢光檢測技術進行網織紅血球計數;人工計數則使用新亞甲藍染色後鏡檢,計算含RNA紅血球的比例。檢測結果可以使用絕對計數[141],也可以採用百分比制[140]。
部分血細胞分析儀可測定網織紅血球平均血紅蛋白含量(CHr),其可以作為鐵缺乏和缺鐵性貧血的新型標誌,是患有干擾標準檢查疾病患者的首選指標[142]。未成熟的紅血球含有更多的RNA,在檢測時會產生更強的螢光信號,因此未成熟網織紅血球計數(IRF)可以量化網織紅血球成熟度。這些信息可用於診斷貧血、評估貧血治療效果和骨髓移植後的紅血球生成狀況[143]。
有核紅血球
[編輯]
紅血球在骨髓和胎兒期的肝臟、脾臟中形成時含有細胞核,但成熟後細胞核就會被去除[144]。有核紅血球在新生兒期屬正常現象[145],但在兒童和成人中出現則提示紅血球需求增加,這種需求增加可能是由出血、惡性腫瘤或嚴重貧血引起的[91]。現代血細胞分析儀可以將有核紅血球納入分類計數。不過大量有核紅血球可能導致白血球計數假性升高,需進行校正[146]。
新型血細胞指標
[編輯]先進的血液分析儀可檢測多項新型血細胞指標,這些指標雖在研究中顯示出診斷潛力,但尚未廣泛應用於臨床實踐[142]。例如,部分分析儀可生成反映白血球簇大小和空間分布的特徵性坐標,該指標被稱為細胞群體數據[暫譯](cell population data)[147],在研究中被認為是血液病、細菌感染和瘧疾的潛在標誌物。採用髓過氧化物酶染色技術的分析儀可定量白血球酶表達水平,為多種疾病的診斷提供參考[60]。另一些儀器除檢測平均紅血球血紅蛋白濃度外,還可檢測低色素紅血球比例和裂紅血球計數[142],這有助於診斷某些類型的溶血性貧血[148]。
參考值範圍
[編輯]| 項目 | 縮寫 | 單位 | 成人 | 小兒
(6–13歲[註 5]) |
新生兒
(28天–6月) |
|---|---|---|---|---|---|
| 白血球計數 | WBC | × 109/L | 3.5–9.5 | 4.3–11.3 | 4.3-14.2 |
| 紅血球計數 | RBC | × 1012/L |
|
4.2-5.7 | 3.3-5.2 |
| 血紅蛋白 | HGB | g/L |
|
118-156 | 97-183 |
| 血細胞比容 | HCT | L/L |
|
0.34-0.36 | 0.28–0.52 |
| 平均紅血球體積 | MCV | fL | 82–100 | 77–92 | 73-104 |
| 平均紅血球血紅蛋白含量 | MCH | pg | 27–34 | 25-34 | 24-37 |
| 平均紅血球血紅蛋白濃度 | MCHC | g/L | 316–354 | 310-355 | 309-363 |
| 血小板計數 | PLT | × 109/L | 125–350 | 167-453 | 183-614 |
| 中性粒細胞絕對值 | NEUT# | × 109/L | 1.8–6.3 | 1.6-7.8 | 0.6-7.5 |
| 淋巴細胞絕對值 | LYMPH# | × 109/L | 1.1–3.2 | 1.5–4.6 | 2.4-9.5 |
| 單核細胞絕對值 | MONO# | × 109/L | 0.1–0.6 | 0.13-0.76 | 0.15-1.56 |
| 嗜酸性粒細胞絕對值 | EOS# | × 109/L | 0.02–0.52 | 0.0–0.68 | 0.07–1.56 |
| 嗜鹼性粒細胞絕對值 | BASO# | × 109/L | 0.0–0.06 | 0.0–0.07 | 0.0–0.1 |
| 中性粒細胞百分數 | NEUT% | % | 40-75 | 31-70 | 7-56 |
| 淋巴細胞百分數 | LYMPH% | % | 20-50 | 23-59 | 23-83 |
| 嗜酸性粒細胞百分數 | EOS% | % | 0.4-8.0 | 0-9 | 1-10 |
| 嗜鹼性粒細胞百分數 | BASO% | % | 0-1 | 0-1 | 0-1 |
| 單核細胞百分數 | MONO% | % | 3-10 | 2-11 | 3-16 |
全血細胞計數的參考值範圍是基於95%健康參考個體的檢測結果確定的分布區間[註 6][152],並且根據常態分布原理,該參考值範圍還因性別和年齡差異而異[153]。換言之,約5%的健康個體檢測結果會不在該參考值範圍,但這種異常反映的可能只是生理性差異而非病理改變[154]。當檢測結果僅輕微偏離參考值範圍、與既往結果一致,或其他檢測指標均正常時,這種可能性尤為顯著[155]。在相對健康人群中檢測時,無臨床意義的異常結果數量往往多於真正提示疾病的異常結果數量[12]。基於此,美國、英國和加拿大的專業組織均建議,對於無相關疾病史的低風險手術患者,術前常規全血細胞計數檢測並非必要[12][156][157]。相反,住院患者頻繁採血進行血液學檢測反而可能導致醫源性貧血,並引發不必要的輸血治療[12]。
通常而言,成年女性的血紅蛋白濃度、血細胞比容和紅血球計數普遍低於成年男性,這種差異在絕經後有所減小但仍存在[153]。兒童與新生兒的全血細胞計數結果與成人存在顯著差異。新生兒的血紅蛋白、血細胞比容和紅血球計數極高,這是對宮內低氧環境的適應性反應,也與胎兒血紅蛋白(其攜氧效率低於成人血紅蛋白)比例較高有關[158][159]。此外,新生兒平均紅血球體積與白血球總數都較高且以中性粒細胞為主[158][160]。出生後,紅血球計數和相關指標逐漸下降,約2月大時達最低值,隨後緩慢回升[161][162]。較大的嬰兒與兒童的紅血球體積較成人小,平均紅血球血紅蛋白含量較低;在白血球分類計數中,淋巴細胞通常超過中性粒細胞,而在成人中,中性粒細胞占主導地位[158]。
地理、人種、生活習慣等其他差異也會影響參考值範圍。如,高海拔地區居民的血紅蛋白、血細胞比容和紅血球計數普遍較高,而非洲裔人群的平均白血球計數相對較低[163],分析儀類型也會影響到檢測結果。因此實驗室需根據本地人群特徵和設備類型建立自己的參考區間[164][165];在使用國家、地區或者組織統一發布的參考值範圍時,實驗室首先需要進行參考值範圍評估和驗證,如果未通過驗證且排除檢測質量問題,應當建立或者引用合適的參考區間[149]。
局限性
[編輯]某些病理狀態或樣本質量問題可能導致檢測結果出現偏差。若樣本出現明顯凝血(多因採血操作不當所致),則不宜進行檢測,因為此時血小板計數會出現假性降低,其他參數也可能異常[166][167]。此外,樣本在室溫下放置過久會造成紅血球從血漿中吸收水分而膨脹,可能導致平均紅血球體積假性升高[168]。

從血漿中膽紅素或脂質水平非常高個體抽取的血液樣本(分別稱為黃疸樣本、脂血樣本)[169]可能出現血紅蛋白假性升高,這是由於這些物質改變了樣本的顏色與透光度[170]。採用生理鹽水置換血漿可減輕此類干擾[75]。
部分個體會對EDTA抗凝劑產生抗體,導致血小板聚集。血細胞分析儀可能將血小板團塊誤認為單個血小板,導致血小板計數假性降低。使用替代抗凝劑(如檸檬酸鈉或肝素)可避免此現象[171][172]。
另一種可能干擾檢測結果的抗體介導疾病是紅血球凝集,即紅血球表面抗體導致細胞聚集[173]。分析儀將凝集紅血球計為單個細胞,導致紅血球計數和血細胞比容假性降低,同時平均紅血球體積和平均紅血球血紅蛋白濃度假性升高[42]。通常,這些抗體僅在室溫下具有活性(此種情況被稱為冷凝集素),並且可以通過將樣本加熱到37°C來逆轉凝集。但溫抗體型自體免疫性溶血性貧血患者也可能會發生紅血球凝集,並且在加熱後仍持續存在[101]。
對於人工分類計數,它雖然可識別原始細胞、淋巴瘤細胞等異常細胞,但難以確定其造血譜系,而這些信息對於診斷惡性血液腫瘤具有重要價值。此時需藉助流式細胞術等其他技術進行免疫表型分析,通過檢測細胞表面標誌物提供診斷信息[174][175]。
歷史
[編輯]
在自動細胞計數技術問世前,全血細胞計數都是人工進行的,檢驗人員需在顯微鏡下逐個計數白血球、紅血球和血小板[177]。第一位發表血細胞顯微鏡觀察結果的人是列文虎克[178],他於1674年致信皇家學會報告報告了紅血球的發現[179]。雖然揚·斯瓦默丹更早觀察到紅血球,但當時並未公開發表。18至19世紀,隨著消色差透鏡等顯微鏡技術的革新,檢驗人員已能在未染色樣本中準確計數白血球和血小板[180]。
生理學家卡爾·維爾羅德第一次進行了血細胞計數[4][181][182],其計數方法於1852年發表。具體而言就是將精確測量的血液吸入毛細管中,並將其塗抹在塗有蛋清的顯微鏡載玻片上。待血液乾燥後,逐個計數載玻片上的細胞;這一過程可能需要三個多小時才能完成[183]。1874年,路易-夏爾·馬拉色發明了血細胞計數器,簡化了血細胞的顯微鏡計數方式[184]。 馬拉色發明的血細胞計數器由一個帶有扁平毛細管的顯微鏡載玻片組成。稀釋的血液通過連接在一端的橡膠管進入管腔,再將刻有縮放網格的目鏡安裝到顯微鏡,使顯微鏡操作者能夠直接計數每體積血液中的細胞數量。1877年,威廉·高爾斯發明了一種帶有內置計數網格的血細胞計數器,使得無需再為每台顯微鏡配置經過專門校準的目鏡[185]。

19世紀70年代,保羅·埃爾利希開發了一種染色技術,將酸性和鹼性染料結合使用,可區分不同類型的白血球,並可對紅血球形態進行檢查[180]。90年代,德米特里·列昂尼多維奇·羅曼諾夫斯基改良了這一技術,他將伊紅和亞甲藍按照一定比例混合起來,發明了羅氏染劑,該染劑在組織染色時可以產生單一染劑無法呈現的豐富色調,該技術至今仍被用於人工複查血液塗片的染色[186]。
19世紀末,首個血紅蛋白測定技術問世,其原理是通過比色法將稀釋血液與已知血紅蛋白濃度的顏色進行目視比對[182]。然而,由於血紅蛋白在血液中存在多種形態,無法在單一波長下準確測定,分光光度法和比色法自動化檢測進程大大受阻。直至1920年,有技術可以將不同形式的血紅蛋白轉化為穩定的氰化高鐵血紅蛋白,這才實現了血紅蛋白水平的自動測定。至今,氰化高鐵血紅蛋白法仍是血紅蛋白測定的主要方法,並廣泛應用於各類自動化血液分析儀中[187][188]。
麥克斯韋·溫特羅布因發明了血細胞比容測試而受到讚譽[189]。1929年,他在杜蘭大學攻讀博士學位期間,為確定紅血球參數的正常參考範圍,發明了溫特羅布血細胞比容測定法。雖然血細胞比容測量方法此前已有文獻記載,但溫特羅布發明了一種可大規模生產、帶有內置刻度並且檢測結果準確的專用試管。離心樣本後測量試管中紅血球比例即可確定血細胞比容值。這種可重複性強的測定方法使溫特羅布得以建立紅血球指數的標準定義[182]。

20世紀初,自動化細胞計數技術的研究拉開序幕[190]。1928年,一種基於光度法的紅血球計數方法問世,該方法通過測量稀釋血液樣本的透光量來估算紅血球數量,但對異常紅血球樣本的識別準確性欠佳[4]。20世紀30至40年代,研究人員還嘗試將光電探測器與顯微鏡結合起來,在光電探測器掃描時計數細胞,但也未取得成功[190]。20世紀40年代末,受廣島與長崎原子彈爆炸後對精確紅血球計數方法的迫切需求推動[191],華萊士·H·庫爾特開始著手改進光電細胞計數技術[註 7]。在芝加哥的一個地下室實驗室中,他得到了兄弟約瑟夫·R·庫爾特(Joseph R. Coulter)的協助[48]。最初他們嘗試使用光電方法,但結果不盡如人意。1948年,華萊士在閱讀了一篇關於血液電導率與紅血球濃度關係的論文後,提出了庫爾特原理:懸浮在導電介質中的細胞通過孔徑時,會產生與其體積成正比的電流變化[191]。
當年10月,華萊士成功製造出基於該原理的計數器演示原型。由於經濟拮据,計數器中的孔徑是在香菸包裝上的玻璃紙上燒一個洞來製成的[48][191]。1949年,華萊士為該技術申請專利,兩年後向海軍研究辦公室申請研發資金[191]。1953年,華萊士的專利獲批後,兄弟倆改進了孔徑設計,引入水銀壓力計以精確控制樣本量,隨後於1958年創立庫爾特電子公司(Coulter Electronics Inc.),開始商業化生產。庫爾特計數器最初設計用於紅血球計數,但在後續改良後也能用於白血球計數[48]。這一革命性儀器迅速在醫學實驗室得到廣泛採用[190]。
儘管基本細胞計數已實現自動化,但白血球分類計數仍面臨挑戰。20世紀70年代,研究人員主要探索了兩種自動化分類計數途徑:數字圖像處理與流式細胞術。基於20世紀50-60年代開發的巴氏塗片自動讀取技術,數種圖像處理分析儀相繼問世[192]。這些儀器通過掃描染色血塗片定位細胞核,隨後拍攝高解析度細胞圖像進行光密度分析[193]。然而,由於設備昂貴、處理速度慢,且仍需人工製備和染色血塗片,對減輕實驗室工作負荷作用有限,因此流式細胞術系統逐漸成為主流[194][192]。至1990年,美國和西歐市場已無商業化數字圖像分析儀銷售[195]。直到21世紀初,採用人工神經網絡的先進圖像分析平台出現,該技術才重新獲得關注[196][194][197]。
早期流式細胞術設備以特定波長光束照射細胞,測量其產生的吸光度、螢光或光散射信號,從而獲取細胞特徵信息並能夠量化DNA等細胞內容物[198]。1965年,路易斯·卡門茨基(Louis Kamentsky)開發的快速細胞分光光度計是其中的典型代表,該儀器採用細胞化學染色技術生成血細胞散點圖,能夠用於宮頸細胞學自動檢查。參與開發該儀器染色系統的倫納德·奧恩斯坦(Leonard Ornstein)及其團隊隨後研製出首款商用流式細胞術白血球分類分析儀Hemalog D[199][200]。該儀器於1974年面世[201][202],利用光散射、吸光度和細胞染色技術,可識別五種正常白血球類型與未識別大型細胞(主要包括非典型淋巴細胞和原始細胞)。Hemalog D單次運行可計數10,000個細胞,較人工分類計數有顯著提升[200][203]</ref>。1981年,Technicon公司推出首款兼具全血細胞計數和分類計數功能的分析儀Technicon H6000。儘管該儀器因操作繁瑣而未能在血液學實驗室廣泛普及,但在20世紀80年代末至90年代初,希森美康、雅培、羅氏和貝克曼庫爾特等醫療器械製造商相繼推出了類似血細胞分析儀[204]。
注釋
[編輯]- ^ 儘管通常被稱為細胞,但嚴格意義上講,血小板並不是細胞,而是由骨髓中的巨核細胞所形成的細胞碎片[2]。
- ^ 從廣義上講,流式細胞術這一術語涵蓋了對流體中單個細胞特性的所有測量方法[39]{{Sfn}Shapiro|2003|p=1}}。基於此定義,除採用數字圖像處理技術的儀器外,所有血細胞分析儀均可歸類為流式細胞儀。然而,在實際應用中,該術語通常特指基於光散射和螢光檢測的技術,尤其是那些涉及利用標記抗體識別細胞表面標誌物(免疫表型分析)鑑定細胞的方法[39][40]。
- ^ 血細胞分析儀會將這三種細胞都歸類到未成熟粒細胞[111],但在人工分類計數中這三種細胞是分開計數的[112]。
- ^ 本表數據來自血細胞分析參考區間(WS/T405-2012)[149]與兒童血細胞分析參考區間(WS/T779-2021)[150]。
- ^ 因數據來源限制,單核細胞百分數使用的是2-18歲年齡段數據,嗜酸性粒細胞百分數使用的是1-18歲年齡段數據,嗜鹼性粒細胞百分數使用的是28天-18歲年齡段數據。
- ^ 用於確立參考範圍的數據通常來自健康受試者,但不排除這些個體患有無症狀疾病的可能[151]。
- ^ 關於庫爾特計數器的起源存在一個廣為流傳說法:華萊士是為研究美國海軍艦艇油漆顆粒而發明了庫爾特計數器;也有說法稱其最初設計目的是用於二戰期間的浮游生物計數。然而,歷史記錄顯示華萊士從未為海軍工作,其早期文獻明確表明該設備是用於血液分析。最終,華萊士·H·庫爾特基金會從有關文件中撤回了有關油漆研究的說法[191]。
引用
[編輯]- ^ 《國際腫瘤學雜誌》編輯部 2013.
- ^ 2.0 2.1 Turgeon 2016,第309頁.
- ^ Harmening 2009,第2-3頁.
- ^ 4.0 4.1 4.2 Green & Wachsmann-Hogiu 2015.
- ^ 5.0 5.1 5.2 鞠秀麗 2020.
- ^ 6.0 6.1 Keohane, Smith & Walenga 2015,第244頁.
- ^ Leach 2014.
- ^ Marshall et al. 2014,第497頁.
- ^ 9.0 9.1 Van Leeuwen & Bladh 2019,第377頁.
- ^ Van Leeuwen & Bladh 2019,第277頁.
- ^ 11.0 11.1 11.2 11.3 11.4 11.5 American Association for Clinical Chemistry 2020.
- ^ 12.0 12.1 12.2 12.3 12.4 Lewandrowski & Rudolf 2016,第96-97頁.
- ^ Napolitano et al. 2009.
- ^ Hartman & Kavoussi 2017,第4-5頁.
- ^ Dewan 2016.
- ^ Walls, Hockberger & Gausche-Hill 2017,第130頁.
- ^ Walls, Hockberger & Gausche-Hill 2017,第199頁.
- ^ Walls, Hockberger & Gausche-Hill 2017,第219頁.
- ^ Walls, Hockberger & Gausche-Hill 2017,第1464頁.
- ^ Moore, Feliciano & Mattox 2017,第162頁.
- ^ Lewis et al. 2015,第280頁.
- ^ Wiciński & Węclewicz 2018.
- ^ Fatemi & Clayton 2016,第666頁.
- ^ 24.0 24.1 Dooley & Ringler 2012,第20-21頁.
- ^ Keohane, Smith & Walenga 2015,第834-835頁.
- ^ Schafermeyer, Tenenbein & Macias 2018,第467-468頁.
- ^ 27.0 27.1 Kaushansky et al. 2015,第11頁.
- ^ Kaushansky et al. 2015,第43頁.
- ^ Kaushansky et al. 2015,第42-44頁.
- ^ McPherson & Pincus 2017,第574頁.
- ^ 彭明婷 2017,第29-30頁.
- ^ Keohane, Smith & Walenga 2015,第28頁.
- ^ Bain, Bates & Laffan 2017,第1頁.
- ^ 中華人民共和國國家衛生健康委員會 2023.
- ^ 35.0 35.1 35.2 35.3 Bain, Bates & Laffan 2017,第551-555頁.
- ^ Bain 2015,第29頁.
- ^ Dasgupta & Sepulveda 2013,第305頁.
- ^ 38.0 38.1 D'Souza, Briggs & Machin 2015.
- ^ 39.0 39.1 39.2 Kottke-Marchant & Davis 2012,第8頁.
- ^ Bakke 2001.
- ^ Kaushansky et al. 2015,第12頁.
- ^ 42.0 42.1 Bain, Bates & Laffan 2017,第32-33頁.
- ^ McPherson & Pincus 2017,第44頁.
- ^ Bain 2015,第29-30頁.
- ^ Whitehead et al. 2019.
- ^ 46.0 46.1 Keohane, Smith & Walenga 2015,第208頁.
- ^ Bain 2015,第30-31頁.
- ^ 48.0 48.1 48.2 48.3 Don 2003.
- ^ Keohane, Smith & Walenga 2015,第208-209頁.
- ^ 50.0 50.1 Bain, Bates & Laffan 2017,第32頁.
- ^ Keohane, Smith & Walenga 2015,第210-211頁.
- ^ Keohane, Smith & Walenga 2015,第210頁.
- ^ Kottke-Marchant & Davis 2012,第27頁.
- ^ Keohane, Smith & Walenga 2015,第2頁.
- ^ Keohane, Smith & Walenga 2015,第209頁.
- ^ 56.0 56.1 56.2 Bain, Bates & Laffan 2017,第37頁.
- ^ Arneth & Menschikowki 2015,第3頁.
- ^ Rao & Grody 2009,第210頁.
- ^ Turgeon 2016,第318頁.
- ^ 60.0 60.1 Bain, Bates & Laffan 2017,第39頁.
- ^ 61.0 61.1 61.2 61.3 Gulati et al. 2013.
- ^ 62.0 62.1 Mooney et al. 2019.
- ^ 63.0 63.1 Sireci 2015.
- ^ Bain, Bates & Laffan 2017,第43頁.
- ^ Keohane, Smith & Walenga 2015,第225頁.
- ^ Bain 2015,第9-11頁.
- ^ Palmer et al. 2015,第288–289頁.
- ^ Turgeon 2016,第325-326頁.
- ^ Bain 2015,第98頁.
- ^ Bain 2015,第154頁.
- ^ Wang & Hasserjian 2018,第10頁.
- ^ 72.0 72.1 Turgeon 2016,第329頁.
- ^ 73.0 73.1 d'Onofrio & Zini 2014,第289頁.
- ^ Palmer et al. 2015,第296–297頁.
- ^ 75.0 75.1 Keohane, Smith & Walenga 2015,第226頁.
- ^ Keohane, Smith & Walenga 2015,第189頁.
- ^ Bain 2015,第22-23頁.
- ^ Keohane, Smith & Walenga 2015,第190-191頁.
- ^ Bain, Bates & Laffan 2017,第19-22頁.
- ^ Bain, Bates & Laffan 2017,第548-552頁.
- ^ Keohane, Smith & Walenga 2015,第4-5頁.
- ^ Blann & Ahmed 2014,第16頁.
- ^ Turgeon 2016,第293頁.
- ^ Bain, Bates & Laffan 2017,第33-34頁.
- ^ Turgeon 2016,第319-320頁.
- ^ Brereton et al. 2016.
- ^ Keohane, Smith & Walenga 2015,第195頁.
- ^ 88.0 88.1 Bain 2015,第22頁.
- ^ 89.0 89.1 89.2 89.3 Keohane, Smith & Walenga 2015,第196頁.
- ^ 90.0 90.1 Bain 2015,第73-75頁.
- ^ 91.0 91.1 91.2 91.3 91.4 May et al. 2019.
- ^ Bain 2015,第297頁.
- ^ DiGregorio et al.
- ^ Isaacs, Agarwala & Cheson 2017,第331頁.
- ^ Bain 2015,第232頁.
- ^ 96.0 96.1 彭明婷 2017,第71頁.
- ^ McPherson & Pincus 2017,第600-601頁.
- ^ Keohane, Smith & Walenga 2015,第285頁.
- ^ Keohane, Smith & Walenga 2015,第286頁.
- ^ Keohane, Smith & Walenga 2015,第197頁.
- ^ 101.0 101.1 Kottke-Marchant & Davis 2012,第88頁.
- ^ Bain 2015,第193頁.
- ^ Bain, Bates & Laffan 2017,第501-502頁.
- ^ Ciesla 2018,第26頁.
- ^ Powell & Achebe 2016,第537-539頁.
- ^ Harmening 2009,第380頁.
- ^ Pagana, Pagana & Pagana 2014,第992頁.
- ^ Walls, Hockberger & Gausche-Hill 2017,第1480-1481頁.
- ^ Pagana, Pagana & Pagana 2014,第991頁.
- ^ 彭明婷 2017.
- ^ Wang & Hasserjian 2018,第8頁.
- ^ Palmer et al. 2015,第294–295頁.
- ^ Chabot-Richards & George 2015,第10頁.
- ^ Palmer et al. 2015,第294-295頁.
- ^ Turgeon 2016,第306頁.
- ^ 116.0 116.1 Kaushansky et al. 2015,第44頁.
- ^ Hoffman et al. 2013,第644頁.
- ^ Porwit, McCullough & Erber 2011,第247-252頁.
- ^ Walls, Hockberger & Gausche-Hill 2017,第1483頁.
- ^ Walls, Hockberger & Gausche-Hill 2017,第1497-1498頁.
- ^ Bain 2015,第99頁.
- ^ Bain, Bates & Laffan 2017,第85頁.
- ^ 王前 & 王建中 2020,第十二章臨床血液學檢驗第一節外周血分析.
- ^ Bain, Bates & Laffan 2017,第498頁.
- ^ Bain 2015,第243頁.
- ^ Porwit, McCullough & Erber 2011,第256頁.
- ^ Palmer et al. 2015,第298頁.
- ^ Turgeon 2016,第358-360頁.
- ^ 129.0 129.1 彭明婷 2017,第443頁.
- ^ Kaushansky et al. 2015,第1993頁.
- ^ Turgeon 2016,第315頁.
- ^ Walls, Hockberger & Gausche-Hill 2017,第1486-1488頁.
- ^ Kaufman et al. 2015.
- ^ 134.0 134.1 中華醫學會血液學分會白血病淋巴瘤學組 2016.
- ^ 135.0 135.1 Keohane, Smith & Walenga 2015,第4頁.
- ^ Walls, Hockberger & Gausche-Hill 2017,第1489頁.
- ^ Wang & Hasserjian 2018,第7頁.
- ^ Kaushansky et al. 2015,第18=19頁.
- ^ 139.0 139.1 彭明婷 2017,第73頁.
- ^ 140.0 140.1 140.2 Turgeon 2016,第318-319頁.
- ^ 141.0 141.1 Kaushansky et al. 2015,第14頁.
- ^ 142.0 142.1 142.2 Kaushansky et al. 2015,第16頁.
- ^ Bain, Bates & Laffan 2017,第42-43頁.
- ^ Harmening 2009,第8-10頁.
- ^ Constantino & Cogionis 2000.
- ^ Zandecki et al. 2017,第24-25頁.
- ^ Virk et al. 2019.
- ^ Bain 2015,第90頁.
- ^ 149.0 149.1 衛生部臨床檢驗標準專業委員會 2013.
- ^ 中華人民共和國國家衛生健康委員會 2021.
- ^ Bain, Bates & Laffan 2017,第8頁.
- ^ Bain, Bates & Laffan 2017,第10頁.
- ^ 153.0 153.1 Bain 2015,第211-213頁.
- ^ Bain 2015,第213頁.
- ^ Keohane, Smith & Walenga 2015,第245頁.
- ^ National Institute for Health and Care Excellence & 2016
- ^ Kirkham et al. 2016.
- ^ 158.0 158.1 158.2 Bain 2015,第143頁.
- ^ Lanzkowsky, Lipton & Fish 2016,第197頁.
- ^ Kaushansky et al. 2015,第99頁.
- ^ Kaushansky et al. 2015,第103頁.
- ^ Bain 2015,第220頁.
- ^ Bain 2015,第214頁.
- ^ Bain, Bates & Laffan 2017,第8-10頁.
- ^ Palmer et al. 2015,第296頁.
- ^ Bain 2015,第195頁.
- ^ Kottke-Marchant & Davis 2012,第67頁.
- ^ Bain 2015,第194頁.
- ^ Turgeon 2016,第91頁.
- ^ Kottke-Marchant & Davis 2012,第86-87頁.
- ^ Bain 2015,第196-197頁.
- ^ Gulati, Uppal & Gong 2022.
- ^ Rodak & Carr 2013,第109頁.
- ^ Wang & Hasserjian 2018,第9頁.
- ^ Kottke-Marchant & Davis 2012,第19-20頁.
- ^ Science Museum, London 2020.
- ^ Keohane, Smith & Walenga 2015,第1-4頁.
- ^ Kottke-Marchant & Davis 2012,第1頁.
- ^ Wintrobe 1985,第10頁.
- ^ 180.0 180.1 Kottke-Marchant & Davis 2012,第3-4頁.
- ^ Verso 1962.
- ^ 182.0 182.1 182.2 Means 2011.
- ^ Davis 1995,第167頁.
- ^ Kottke-Marchant & Davis 2012,第4頁.
- ^ Davis 1995,第168-171頁.
- ^ Bezrukov 2017.
- ^ Keohane, Smith & Walenga 2015,第134頁.
- ^ Kottke-Marchant & Davis 2012,第85頁.
- ^ Robinson 2013.
- ^ 190.0 190.1 190.2 Kottke-Marchant & Davis 2012,第5頁.
- ^ 191.0 191.1 191.2 191.3 191.4 Graham 2013.
- ^ 192.0 192.1 Groner 1995,第12-15頁.
- ^ Lewis 1981.
- ^ 194.0 194.1 Da Costa 2015.
- ^ Bentley 1990.
- ^ Kratz et al. 2019.
- ^ McCann 2016,第193頁.
- ^ melamed 2001,第5-6頁.
- ^ Shapiro 2003,第84-85頁.
- ^ 200.0 200.1 melamed 2001,第8頁.
- ^ Picot et al. 2012,第110頁.
- ^ Mansberg, Saunders & Groner 1974.
- ^ Pierre}2002,第281頁.
- ^ Kottke-Marchant & Davis 2012,第8-9頁.
參考資料
[編輯]網頁
[編輯]- American Association for Clinical Chemistry. Complete Blood Count (CBC). Lab Tests Online. 12 August 2020 [8 September 2020]. (原始內容存檔於18 August 2020) (英語).
- American Association for Clinical Chemistry. WBC Differential. Lab Tests Online. 29 July 2020 [8 September 2020]. (原始內容存檔於19 August 2020) (英語).
- Routine Preoperative Tests for Elective Surgery (NG45). National Institute for Health and Care Excellence. 5 April 2016 [8 September 2020]. (原始內容存檔於28 July 2020) (英語).
- Science Museum, London. Haemoglobinometer, United Kingdom, 1850–1950. Wellcome Collection. 2020 [29 March 2020]. (原始內容存檔於29 March 2020) (英語).
期刊
[編輯]- 《國際腫瘤學雜誌》編輯部. 医学专业术语的规范使用. 國際腫瘤學雜誌. 2013, 40 (2): 140-140.
- 鞠秀麗. 血常规在感染判定的价值. 中國小兒急救醫學. 2020. doi:10.3760/cma.j.issn.1673-4912.2020.03.002
 .
. - 中華醫學會血液學分會白血病淋巴瘤學組. 原发性血小板增多症诊断与治疗中国专家共识(2016年版). 中華血液學雜誌. 2016, (10): 833-836. PMID 27801309. doi:10.3760/cma.j.issn.0253-2727.2016.10.001.
- Leach, M. Interpretation of the full blood count in systemic disease – a guide for the physician. The Journal of the Royal College of Physicians of Edinburgh. 2014, 44 (1): 36–41. ISSN 1478-2715. PMID 24995446. doi:10.4997/JRCPE.2014.109
 (英語).
(英語). - Arneth, BM; Menschikowki, M. Technology and new fluorescence flow cytometry parameters in hematological analyzers. Journal of Clinical Laboratory Analysis. 2015, 29 (3): 175–183. ISSN 0887-8013. PMC 6807107
 . PMID 24797912. doi:10.1002/jcla.21747 (英語).
. PMID 24797912. doi:10.1002/jcla.21747 (英語). - Green, R; Wachsmann-Hogiu, S. Development, history, and future of automated cell counters. Clinics in Laboratory Medicine. 2015, 35 (1): 1–10. ISSN 0272-2712. PMID 25676368. doi:10.1016/j.cll.2014.11.003 (英語).
- Whitehead, RD; Mei, Z; Mapango, C; Jefferds, MED. Methods and analyzers for hemoglobin measurement in clinical laboratories and field settings. Annals of the New York Academy of Sciences. August 2019, 1450 (1): 147–171. Bibcode:2019NYASA1450..147W. PMC 6709845
 . PMID 31162693. doi:10.1111/nyas.14124 (英語).
. PMID 31162693. doi:10.1111/nyas.14124 (英語). - Dewan, M. Reducing unnecessary postoperative complete blood count testing in the pediatric intensive care unit. The Permanente Journal. 2016, 21: 16–051. ISSN 1552-5767. PMC 5283785
 . PMID 28241909. doi:10.7812/TPP/16-051 (英語).
. PMID 28241909. doi:10.7812/TPP/16-051 (英語). - Constantino, B; Cogionis, B. Nucleated RBCs – significance in the peripheral blood film. Laboratory Medicine. 2000, 31 (4): 223–229. doi:10.1309/D70F-HCC1-XX1T-4ETE
 (英語).
(英語). - Brereton, M; McCafferty, R; Marsden, K; Kawai, Y; Etzell, J; Ermens, A. Recommendation for standardization of haematology reporting units used in the extended blood count. International Journal of Laboratory Hematology. 2016, 38 (5): 472–482. ISSN 1751-5521. PMID 27565952. doi:10.1111/ijlh.12563
 (英語).
(英語). - D'Souza, C; Briggs, C; Machin, SJ. Platelets: the few, the young and the active. Clinics in Laboratory Medicine. 2015, 35 (1): 123–131. ISSN 0272-2712. PMID 25676376. doi:10.1016/j.cll.2014.11.002 (英語).
- Gulati, G; Uppal, G; Gong, J. Unreliable automated complete blood count results: causes, recognition, and resolution. Annals of Laboratory Medicine. 2022, 42 (5): 515–530. PMC 9057813
 . PMID 35470271. doi:10.3343/alm.2022.42.5.515 (英語).
. PMID 35470271. doi:10.3343/alm.2022.42.5.515 (英語). - Verso, ML. The evolution of blood counting techniques. Read at a Meeting of the Section of the History of Medicine, First Australian Medical Congress. 1962, 8 (2): 149–158. PMC 1033366
 . PMID 14139094. doi:10.1017/s0025727300029392 (英語).
. PMID 14139094. doi:10.1017/s0025727300029392 (英語). - Bentley, SA. Automated differential white cell counts: a critical appraisal. Baillière's Clinical Haematology. 1990, 3 (4): 851–869. ISSN 0950-3536. PMID 2271793. doi:10.1016/S0950-3536(05)80138-6 (英語).
- Green, R; Wachsmann-Hogiu, S. Development, history, and future of automated cell counters. Clinics in Laboratory Medicine. 2015, 35 (1): 1–10. ISSN 0272-2712. PMID 25676368. doi:10.1016/j.cll.2014.11.003 (英語).
- Means, RT. It all started in New Orleans: Wintrobe, the hematocrit and the definition of normal. The American Journal of the Medical Sciences. 2011, 341 (1): 64–65. ISSN 0002-9629. PMID 21191263. doi:10.1097/MAJ.0b013e3181e2eb09 (英語).
- Robinson, JP. Wallace H. Coulter: decades of invention and discovery. Cytometry Part A. 2013, 83A (5): 424–438. ISSN 1552-4922. PMID 23596093. doi:10.1002/cyto.a.22296
 (英語).
(英語). - Wiciński, M; Węclewicz, MM. Clozapine-induced agranulocytosis/granulocytopenia. Current Opinion in Hematology. 2018, 25 (1): 22–28. ISSN 1065-6251. PMID 28984748. S2CID 20375973. doi:10.1097/MOH.0000000000000391 (英語).
- May, JE; Marques, MB; Reddy, VVB; Gangaraju, R. Three neglected numbers in the CBC: The RDW, MPV, and NRBC count. Cleveland Clinic Journal of Medicine. 2019, 86 (3): 167–172. ISSN 0891-1150. PMID 30849034. doi:10.3949/ccjm.86a.18072
 (英語).
(英語). - Bakke, AC. The principles of flow cytometry. Laboratory Medicine. 2001, 32 (4): 207–211. ISSN 1943-7730. doi:10.1309/2H43-5EC2-K22U-YC6T
 (英語).
(英語). - Don, Marshall. The Coulter Principle: Foundation of an Industry. JALA: Journal of the Association for Laboratory Automation. 2003, 8 (6): 72–81 [2025-03-02]. ISSN 1535-5535. doi:10.1016/s1535-5535(03)00023-6
 (英語).
(英語). - Mooney, C; Byrne, M; Kapuya, P; Pentony, L; De la Salle, B; Cambridge, T; Foley, D. Point of care testing in general haematology. British Journal of Haematology. 2019, 187 (3): 296–306. ISSN 0007-1048. PMID 31578729. doi:10.1111/bjh.16208
 (英語).
(英語). - Kratz, A; Lee, S; Zini, G; Riedl, JA; Hur, M; Machin, S. Digital morphology analyzers in hematology: ICSH review and recommendations. International Journal of Laboratory Hematology. 2019, 41 (4): 437–447. ISSN 1751-5521. PMID 31046197. doi:10.1111/ijlh.13042
 (英語).
(英語). - Bezrukov, AV. Romanowsky staining, the Romanowsky effect and thoughts on the question of scientific priority. Biotechnic & Histochemistry. 2017, 92 (1): 29–35. ISSN 1052-0295. PMID 28098484. S2CID 37401579. doi:10.1080/10520295.2016.1250285 (英語).
- Mansberg, HP; Saunders, AM; Groner, W. The Hemalog D white cell differential system. Journal of Histochemistry & Cytochemistry. 1974, 22 (7): 711–724. ISSN 0022-1554. PMID 4137312. doi:10.1177/22.7.711
 (英語).
(英語). - Kaufman, RM; Djulbegovic, B; Gernsheimer, T; Kleinman, S; Tinmouth, A T.; Capocelli, KE; et al. Platelet transfusion: a clinical practice guideline from the AABB. Annals of Internal Medicine. 2015, 162 (3): 205–213. ISSN 0003-4819. PMID 25383671. doi:10.7326/M14-1589
 (英語).
(英語). - Lewis, SM. Automated differential leucocyte counting: Present status and future trends. Blut. 1981, 43 (1): 1–6. ISSN 0006-5242. PMID 7260399. S2CID 31055044. doi:10.1007/BF00319925 (英語).
- Virk, H; Varma, N; Naseem, S; Bihana, I; Sukhachev, D. Utility of cell population data (VCS parameters) as a rapid screening tool for acute myeloid leukemia (AML) in resource-constrained laboratories. Journal of Clinical Laboratory Analysis. 2019, 33 (2): e22679. ISSN 0887-8013. PMC 6818587
 . PMID 30267430. doi:10.1002/jcla.22679
. PMID 30267430. doi:10.1002/jcla.22679  (英語).
(英語). - Green, R; Wachsmann-Hogiu, S. Development, history, and future of automated cell counters. Clinics in Laboratory Medicine. 2015, 35 (1): 1–10. ISSN 0272-2712. PMID 25676368. doi:10.1016/j.cll.2014.11.003 (英語).
- Chabot-Richards, DS; George, TI. White blood cell counts. Clinics in Laboratory Medicine. 2015, 35 (1): 11–24. ISSN 0272-2712. PMID 25676369. doi:10.1016/j.cll.2014.10.007 (英語).
- Da Costa, L. Digital image analysis of blood cells. Clinics in Laboratory Medicine. 2015, 35 (1): 105–122. ISSN 0272-2712. PMID 25676375. doi:10.1016/j.cll.2014.10.005 (英語).
- Dasgupta, A; Sepulveda, JL. Accurate Results in the Clinical Laboratory: A Guide to Error Detection and Correction. Elsevier. 2013. ISBN 978-0-12-415858-0 (英語).
- Davis, JD. The evolution of the progressive-era hemocytometer.. Caduceus: A Humanities Journal for Medicine and the Health Sciences. 1995, 11 (3): 164–183. PMID 8680947 (英語).
- D'Souza, C; Briggs, C; Machin, SJ. Platelets: the few, the young and the active. Clinics in Laboratory Medicine. 2015, 35 (1): 123–131. ISSN 0272-2712. PMID 25676376. doi:10.1016/j.cll.2014.11.002 (英語).
- Dooley, EK; Ringler, RL. Prenatal care: touching the future. Primary Care: Clinics in Office Practice. 2012, 39 (1): 17–37. ISSN 0095-4543. PMID 22309579. doi:10.1016/j.pop.2011.11.002 (英語).
- Sireci, AN. Hematology testing in urgent care and resource-poor settings: an overview of point of care and satellite testing. Clinics in Laboratory Medicine. 2015, 35 (1): 197–207. ISSN 0272-2712. PMID 25676380. doi:10.1016/j.cll.2014.10.009 (英語).
- Vieth, JT; Lane, DR. Anemia. Emergency Medicine Clinics of North America. 2014, 32 (3): 613–628. ISSN 0733-8627. PMID 25060253. doi:10.1016/j.emc.2014.04.007 (英語).
- Palmer, L; Briggs, C; McFadden, S; Zini, G; Burthem, J; Rozenberg, G; Proytcheva, M; Machin, SJ. ICSH recommendations for the standardization of nomenclature and grading of peripheral blood cell morphological features. International Journal of Laboratory Hematology. 2015, 37 (3): 287–303. ISSN 1751-5521. PMID 25728865. doi:10.1111/ijlh.12327
 (英語).
(英語). - Picot, J; Guerin, CL; Le Van Kim, C; Boulanger, C. Flow cytometry: retrospective, fundamentals and recent instrumentation. Cytotechnology. 2012, 64 (2): 109–130. ISSN 0920-9069. PMC 3279584
 . PMID 22271369. doi:10.1007/s10616-011-9415-0 (英語).
. PMID 22271369. doi:10.1007/s10616-011-9415-0 (英語). - Kirkham, KR; Wijeysundera, DN; Pendrith, C; Ng, R; Tu, JV; Boozary, AS; et al. Preoperative laboratory investigations. Anesthesiology. 2016, 124 (4): 804–814. ISSN 0003-3022. PMID 26825151. S2CID 35916964. doi:10.1097/ALN.0000000000001013 (英語).
- Graham, MD. The Coulter principle: Imaginary origins. Cytometry Part A. 2013, 83 (12): 1057–1061. ISSN 1552-4922. PMC 4237176
 . PMID 24151220. doi:10.1002/cyto.a.22398 (英語).
. PMID 24151220. doi:10.1002/cyto.a.22398 (英語). - Pierre, RV. Peripheral blood film review: the demise of the eyecount leukocyte differential. Clinics in Laboratory Medicine. 2002, 22 (1): 279–297. ISSN 0272-2712. PMID 11933579. doi:10.1016/S0272-2712(03)00075-1 (英語).
- Powell, DJ; Achebe, MO. Anemia for the primary care physician. Primary Care: Clinics in Office Practice. 2016, 43 (4): 527–542. ISSN 0095-4543. PMID 27866575. doi:10.1016/j.pop.2016.07.006 (英語).
- Zandecki, M; Genevieve, F; Gerard, J; Godon, A. Spurious counts and spurious results on haematology analysers: a review. Part II: white blood cells, red blood cells, haemoglobin, red cell indices and reticulocytes. International Journal of Laboratory Hematology. February 2007, 29 (1): 21–41. PMID 17224005. doi:10.1111/j.1365-2257.2006.00871.x
 (英語).
(英語). - Gulati, G; Song, J; Dulau Florea, A; Gong, J. Purpose and criteria for blood smear scan, blood smear examination, and blood smear review. Annals of Laboratory Medicine. 2013, 33 (1): 1–7. ISSN 2234-3806. PMC 3535191
 . PMID 23301216. doi:10.3343/alm.2013.33.1.1 (英語).
. PMID 23301216. doi:10.3343/alm.2013.33.1.1 (英語). - Napolitano, Lena M.; Kurek, Stanley; Luchette, Fred A.; Anderson, Gary L.; Bard, Michael R.; Bromberg, William; Chiu, William C.; Cipolle, Mark D.; Clancy, Keith D.; Diebel, Lawrence; Hoff, William S.; Hughes, K Michael; Munshi, Imtiaz; Nayduch, Donna; Sandhu, Rovinder; Yelon, Jay A.; Corwin, Howard L.; Barie, Philip S.; Tisherman, Samuel A.; Hebert, Paul C. Clinical Practice Guideline: Red Blood Cell Transfusion in Adult Trauma and Critical Care. Journal of Trauma: Injury, Infection & Critical Care. 2009, 67 (6): 1439–1442. ISSN 0022-5282. doi:10.1097/TA.0b013e3181ba7074
 (英語).
(英語).
書籍
[編輯]- 彭明婷. 临床医学与血液检验. 北京: 人民衛生出版社. 2017. ISBN 978-7117251679.
- 王前; 王建中. 临床检验医学(第2版). 北京: 人民衛生出版社. 2020. ISBN 9787117310338.
- 中華人民共和國國家衛生健康委員會. 临床血液与体液检验基本技术标准 (PDF). 2023.
- 中華人民共和國國家衛生健康委員會. 儿童血细胞分析参考区间准 (PDF). 2021.
- 衛生部臨床檢驗標準專業委員會. 血细胞分析参考区间 (PDF). 中華人民共和國衛生部. 2013 [2025-02-28].
- Bain, BJ; Bates, I; Laffan, MA. Dacie and Lewis Practical Haematology 12. Elsevier Health Sciences. 2017. ISBN 978-0-7020-6925-3 (英語).
- Bain, BJ. Blood Cells: A Practical Guide 5. John Wiley & Sons. 2015. ISBN 978-1-118-81733-9 (英語).
- Ciesla, B. Hematology in Practice 3. F. A. Davis Company. 2018. ISBN 978-0-8036-6825-6 (英語).
- Blann, A; Ahmed, N. Blood Science 1. Institute of Biomedical Science. 2014: 106. ISBN 978-1-118-35146-8 (英語).
- DiGregorio, RV; Green-Hernandez, C; Holzemer, SP. Primary Care: An Interprofessional Perspective 2. Springer Publishing Company. 2014. ISBN 978-0-8261-7148-1 (英語).
- Fatemi, SH; Clayton, PJ. The Medical Basis of Psychiatry 4. Springer. 2016. ISBN 978-1-4939-2528-5 (英語).
- Greer, JP. Wintrobe's Clinical Hematology 12. Lippincott Williams & Wilkins. 2008. ISBN 978-0-7817-6507-7 (英語).
- Greer, JP; Arber, DA; Glader, BE; List, AF; Means, RM; Rodgers, GM. Wintrobe's Clinical Hematology 14. Wolters Kluwer Health. 2018. ISBN 978-1-4963-6713-6 (英語).
- Groner, W. Practical Guide to Modern Hematology Analyzers. Wiley. 1995. ISBN 978-0-471-95712-6 (英語).
- Harmening, D. Clinical Hematology and Fundamentals of Hemostasis 5. F. A. Davis Company. 2009. ISBN 978-0-8036-1732-2 (英語).
- Hartman, CJ; Kavoussi, LR. Handbook of Surgical Technique: A True Surgeon's Guide to Navigating the Operating Room. Elsevier Health Sciences. 2017. ISBN 978-0-323-51222-0 (英語).
- Hoffman, R; Benz, EJ Jr.; Silberstein, LE; Heslop, H; Anastasi, J; Weitz, J. Hematology: Basic Principles and Practice 6. Elsevier Health Sciences. 2013. ISBN 978-1-4377-2928-3 (英語).
- Isaacs, C; Agarwala, S; Cheson, B. Hoffman and Abeloff's Hematology-Oncology Review 1. Elsevier Health Sciences. 2017. ISBN 978-0-323-44318-0 (英語).
- Kaushansky, K; Lichtman, MA; Prchal, J; Levi, MM; Press, OW; Burns, LJ; Caligiuri, M. Williams Hematology 9. McGraw-Hill Education. 2015. ISBN 978-0-07-183301-1 (英語).
- Keohane, E; Smith, L; Walenga, J. Rodak's Hematology: Clinical Principles and Applications 5. Elsevier Health Sciences. 2015. ISBN 978-0-323-23906-6 (英語).
- Kottke-Marchant, K; Davis, B. Laboratory Hematology Practice 1. John Wiley & Sons. 2012. ISBN 978-1-4443-9857-1 (英語).
- Lanzkowsky, P; Lipton, JM; Fish, JD. Lanzkowsky's Manual of Pediatric Hematology and Oncology. Elsevier Science. 2016. ISBN 978-0-12-801674-9 (英語).
- Lewandrowski, K; Rudolf, J. Utilization Management in the Routine Hematology Laboratory. Lewandrowski J, Sluss PM (編). Utilization Management in the Clinical Laboratory and Other Ancillary Services. Springer. 2016. ISBN 978-3-319-34199-6. doi:10.1007/978-3-319-34199-6_10 (英語).
- Lewis, SL; Dirksen, SR; Heitkempet, MM; Bucher, L; Camera, I. Medical-Surgical Nursing: Assessment and Management of Clinical Problems, Single Volume 8. Elsevier Health Sciences. 2015. ISBN 978-0-323-29033-3 (英語).
- Marshall, WJ; Lapsley, M; Day, A; Ayling, R. Clinical Biochemistry E-Book: Metabolic and Clinical Aspects 3. Elsevier Health Sciences. 2014. ISBN 978-0-7020-5478-5 (英語).
- McCann, SR. A History of Haematology: From Herodotus to HIV. OUP Oxford. 2016. ISBN 978-0-19-102713-0 (英語).
- McPherson, RA; Pincus, MR. Henry's Clinical Diagnosis and Management by Laboratory Methods 23. Elsevier Health Sciences. 2017. ISBN 978-0-323-41315-2 (英語).
- Melamed, M. Chapter 1 a brief history of flow cytometry and sorting. Methods in Cell Biology. 63 part A. Elsevier. 2001: 3–17. ISBN 978-0-12-544166-7. PMID 11060834. doi:10.1016/S0091-679X(01)63005-X (英語).
- Moore, EE; Feliciano, DV; Mattox, KL. Trauma 8. McGraw-Hill Education. 2017. ISBN 978-1-260-12860-4 (英語).
- Naeim, F; Rao, PN; Grody, WW. Hematopathology: Morphology, Immunophenotype, Cytogenetics, and Molecular Approaches 1. Academic Press. 2009. ISBN 978-0-08-091948-5 (英語).
- d'Onofrio, G; Zini, G. Morphology of Blood Disorders 2. Wiley. 2014. ISBN 978-1-118-44258-6 (英語).
- Oropello, JM; Kvetan, V; Pastores, SM. Lange Critical Care. McGraw-Hill Education. 2016. ISBN 978-0-07-181726-4 (英語).
- Pagana, Kathleen Deska; Pagana, Timothy J.; Pagana, Theresa N. Mosby's Diagnostic and Laboratory Test Reference - E-Book. Elsevier Health Sciences. 2014-09-19. ISBN 978-0-323-22592-2 (英語).
- Porwit, A; McCullough, J; Erber, WN. Blood and Bone Marrow Pathology 2. Elsevier Health Sciences. 2011. ISBN 978-0-7020-4535-6 (英語).
- Rodak, BF; Carr, JH. Clinical Hematology Atlas 4. Elsevier Health Sciences. 2013. ISBN 978-1-4557-0830-7 (英語).
- Schafermeyer, RW; Tenenbein, M; Macias, CJ. Strange and Schafermeyer's Pediatric Emergency Medicine 5. McGraw-Hill Education. 2018. ISBN 978-1-259-86076-8 (英語).
- Shapiro, HM. Practical Flow Cytometry 4. John Wiley & Sons. 2003. ISBN 978-0-471-43403-0 (英語).
- Schmaier, AH; Lazarus, HM. Concise guide to hematology 1. Wiley-Blackwell. 2012. ISBN 978-1-4051-9666-6 (英語).
- Turgeon, ML. Linné & Ringsrud's Clinical Laboratory Science: Concepts, Procedures, and Clinical Applications 7. Elsevier Mosby. 2016. ISBN 978-0-323-22545-8 (英語).
- Van Leeuwen, AM; Bladh, ML. Davis's Comprehensive Manual of Laboratory and Diagnostic Tests with Nursing Implications 8. F. A. Davis Company. 2019. ISBN 978-0-8036-9448-4 (英語).
- Walls, R; Hockberger, R; Gausche-Hill, M. Rosen's Emergency Medicine - Concepts and Clinical Practice 9. Elsevier Health Sciences. 2017. ISBN 978-0-323-39016-3 (英語).
- Wang, SA; Hasserjian, RP. Diagnosis of Blood and Bone Marrow Disorders. Springer. 2018. ISBN 978-3-319-20279-2 (英語).
- Wintrobe, MM. Hematology, the Blossoming of a Science: A Story of Inspiration and Effort. Lea & Febiger. 1985. ISBN 978-0-8121-0961-0 (英語).


