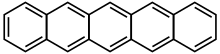
并五苯
| 并五苯 | |
|---|---|
| |

| |
| 识别 | |
| CAS号 | 135-48-8 |
| PubChem | 8671 |
| ChemSpider | 8347 |
| SMILES |
|
| InChI |
|
| InChIKey | SLIUAWYAILUBJU-UHFFFAOYAR |
| ChEBI | 33148 |
| 性质 | |
| 化学式 | C22H14 |
| 摩尔质量 | 278.36 g/mol g·mol⁻¹ |
| 外观 | 暗紫色粉末 |
| 密度 | 1.3 g/cm3 |
| 熔点 | > 300 °C; 于372 °C升华 |
| 结构 | |
| 晶体结构 | 三斜晶系 |
| 空间群 | P-1 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
并五苯(英語:Pentacene)是一种五个苯环由直线状稠合组成的一种多环芳香烃,化学式C22H14。并五苯对光和氧气敏感,市售并五苯常因氧化而表面带绿色。并五苯是一种有机半导体。
合成
[编辑]
最初的使用合成路线在1961年提出,由邻苯二甲醛与1,4-环己二酮通过羟醛缩合得并五苯醌,再由铝汞齐还原得并五苯。[1]

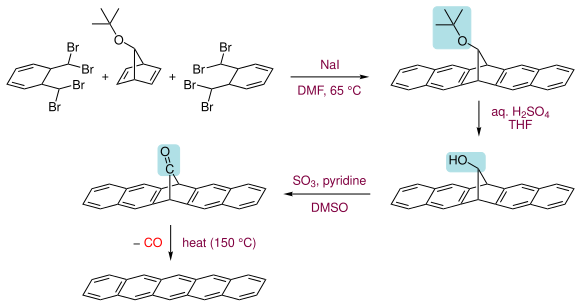
另一种合成法首先得到一个羰基桥环的前体化合物,再于150℃[2],或经光照[3]失1分子CO,得并五苯。该前体化合物溶于氯仿,而并五苯不溶于一般有机溶剂,因此该法适用于以旋转涂覆制得并五苯薄膜。并五苯溶于热的氯代苯,可用1,2,4-三氯苯作溶剂重结晶。
衍生物
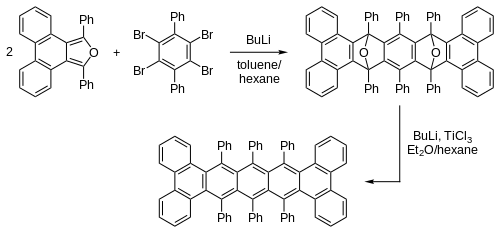
[编辑]6,13-取代并五苯通过芳基或炔基亲核试剂(如格氏试剂与有机锂试剂)与并五苯醌的反应,随后经芳构化的还原反应得到。[4][5][6]由二炔与环戊二烯基锆反应生成金属有机化合物中间体,再与丁炔二酸二甲酯反应,得到的酯又可通过碳链增长生成二炔,经此同系化步骤可得多取代并五苯。[7][8][9][10][11]通过引入不同官能团,达到控制化合物颜色,电化学性质和晶体中分子排列的目的。[12][13]通过取代基的选择(包括大小和位置)能控制衍生物采用一维抑或二维共面的堆积,这与并五苯晶体中人字形排列的分子相异。
虽然并五苯的结构类似于其他芳香族化合物如蒽,但其对其芳香性的解释还不完善。因此,并五苯及其衍生物是许多研究的主题。
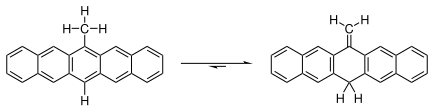
6-亚甲基-6,13-二氢并五苯与6-甲基并五苯间存在以下平衡:
常温下此平衡极大偏向于亚甲基方向。在溶液中加热至°C时,有少量亚甲基异构体转化为甲基异构体,此时溶液显红紫色。 根据一项研究,[14]此反应的机理不是分子内H[1,5]σ迁移,而是双分子自由基的氢迁移。相比之下,结构类似异甲苯(亚甲基环己二烯)则相当不稳定。
并五苯与硫在1,2,4 - 三氯苯中反应得六硫并五苯.[15] X射线晶体衍射实验结果显示所有的碳硫键键长相似(170 pm),从共振论的角度解释,电荷分离的两种共振式B、C的贡献比结构A更大。
晶相中相邻分子的硫原子间距(337 pm)小于分子的范德华半径(180 pm)的两倍,这是由于相邻分子间存在π重叠的缘故。作为有机半导体,此性质与四硫富瓦烯相似。
并五苯骨架平面看上去是刚性的,但事实上,大取代基可以使其变得相当扭曲:[16]
由于六个苯基的存在,骨架两端扭曲达144°,此化合物具有光学活性,可拆分为一对旋光异构体,旋光度高达7400°,其外消旋化半衰期为9小时。
应用
[编辑]
并五苯与富勒烯结合,用于有机光伏电池的研究。[17][18]
并五苯是有机薄膜晶体管(OTFT)和有机场效应晶体管(OFET)研究的主流半导体材料,是研究最全面深入的共轭有机分子(conjugated organic molecules)。由于其作为有机场效应晶体管的空穴迁移率最高可达5.5 cm2/(V·s),超过了非晶硅,具有很大的应用前景。[19][20][21]
并五苯以及其他有机半导体在空气中会迅速氧化,故其作为有机半导体的商业价值不高。但其经氧化处理得到的并五苯醌具有栅极绝缘膜方面的应用价值[20]
参见
[编辑]参考资料
[编辑]- ^ Bruckner, V.; Tomasz, J. Acta. Chim. Hung. 1961, 28, 405–408.
- ^ Chen, Kew-Yu; Hsieh, HH; Wu, CC; Hwang, JJ; Chow, TJ. A new type of soluble pentacene precursor for organic thin-film transistors. Chemical Communications. 2007, (10): 1065–7. PMID 17325807. doi:10.1039/b616511g.
- ^ Yamada, H.; Yamashita, Y.; Kikuchi, M.; Watanabe, H.; Okujima, T.; Uno, H.; Ogawa, T.; Ohara, K.; Ono, N. "Photochemical Synthesis of Pentacene and its Derivatives." Chem. Eur. J. 2005, 11, 6212–6220. doi:10.1002/chem.200500564
- ^ Allen, C. F. H.; Bell, Alan. Journal of the American Chemical Society. 1942, 64 (6): 1253. doi:10.1021/ja01258a005. 缺少或
|title=为空 (帮助) - ^ Maulding, D. R.; Roberts, Bernard G. Electronic absorption and fluorescence of phenylethynyl-substituted acenes. The Journal of Organic Chemistry. 1969, 34 (6): 1734. doi:10.1021/jo01258a045.
- ^ Li, Shi; Zhou, Lishan; Nakajima, Kiyohiko; Kanno, Ken-Ichiro; Takahashi, Tamotsu. Synthesis of 1,2,3,4,8,9,10,11-Octasubstituted Pentacenequinone Derivatives and their Conversion into Substituted Pentacenes. Chemistry – an Asian Journal. 2010, 5 (7): 1620–6. PMID 20455241. doi:10.1002/asia.200900754.
- ^ Takahashi, Tamotsu; Kitamura, Masanori; Shen, Baojian; Nakajima, Kiyohiko. Straightforward Method for Synthesis of Highly Alkyl-Substituted Naphthacene and Pentacene Derivatives by Homologation. Journal of the American Chemical Society. 2000, 122 (51): 12876. doi:10.1021/ja003130g.
- ^ Takahashi, Tamotsu; Li, Shi; Huang, Wenying; Kong, Fanzhi; Nakajima, Kiyohiko; Shen, Baojian; Ohe, Takahiro; Kanno, Ken-Ichiro. Homologation Method for Preparation of Substituted Pentacenes and Naphthacenes. The Journal of Organic Chemistry. 2006, 71 (21): 7967–77. PMID 17025283. doi:10.1021/jo060923y.
- ^ Takahashi, Tamotsu; Li, Yanzhong; Hu, Jinghan; Kong, Fanzhi; Nakajima, Kiyohiko; Zhou, Lishan; Kanno, Ken-Ichiro. Cu(I)-mediated cycloaddition reaction of zirconacyclopentadienes with fumaronitrile and application for synthesis of monocyano-substituted pentacenes. Tetrahedron Letters. 2007, 48 (38): 6726. doi:10.1016/j.tetlet.2007.07.075.
- ^ Stone, Matthew T.; Anderson, Harry L. Three-Step Synthesis of End-Substituted Pentacenes. The Journal of Organic Chemistry. 2007, 72 (25): 9776–8. PMID 17999529. doi:10.1021/jo7017284.
- ^ Li, Shi; Li, Zhiping; Nakajima, Kiyohiko; Kanno, Ken-Ichiro; Takahashi, Tamotsu. Double Homologation Method for Substituted Soluble Pentacenes and Dimerization Behaviours of Pentacenes. Chemistry – an Asian Journal. 2009, 4 (2): 294–301. PMID 19072938. doi:10.1002/asia.200800312.
- ^ Anthony, J. E.; Brooks, J. S.; Eaton, D. L.; Parkin, S. R. Functionalized Pentacene: Improved Electronic Properties from Control of Solid-State Order. Journal of the American Chemical Society. 2001, 123 (38): 9482–9483 [2013-07-27]. PMID 11562247. doi:10.1021/ja0162459. (原始内容存档于2017-05-21).
- ^ Anthony, J. E.; Eaton, D. L.; Parkin, S. R. A Road Map to Stable, Soluble, Easily Crystallized Pentacene Derivatives. Organic Letters. 2002, 4 (1): 15–18. PMID 11772079. doi:10.1021/ol0167356.
- ^ Norton, Joseph E.; Northrop, BH; Nuckolls, C; Houk, KN. Why 6-Methylpentacene Deconjugates but Avoids the Thermally Allowed Unimolecular Mechanism. Organic Letters. 2006, 8 (21): 4915–8. PMID 17020335. doi:10.1021/ol062012g.
- ^ Briseno, Alejandro L.; Miao, Q; Ling, MM; Reese, C; Meng, H; Bao, Z; Wudl, F. Hexathiapentacene: Structure, Molecular Packing, and Thin-Film Transistors. Journal of the American Chemical Society. 2006, 128 (49): 15576–7. PMID 17147352. doi:10.1021/ja066088j..
- ^ Lu, Jun; Ho, DM; Vogelaar, NJ; Kraml, CM; Bernhard, S; Byrne, N; Kim, LR; Pascal Jr, RA. Synthesis, Structure, and Resolution of Exceptionally Twisted Pentacenes. Journal of the American Chemical Society. 2006, 128 (51): 17043–50. PMID 17177456. doi:10.1021/ja065935f.
- ^ 17.0 17.1 Dissanayake, D. M. Nanditha M. Nanoimprinted large area heterojunction pentacene-C[sub 60] photovoltaic device. Applied Physics Letters. 2007, 90 (25): 253502. Bibcode:2007ApPhL..90y3502D. doi:10.1063/1.2749863.
- ^ 18.0 18.1 Efficiently Organic: Researchers Use Pentacene To Develop Next-generation Solar Power sciencedaily.com Link (页面存档备份,存于互联网档案馆)
- ^ Norbert Koch. Organic Electronic Devices and Their Functional Interfaces. ChemPhysChem. 2007, 8 (10): 1438–55. PMID 17539032. doi:10.1002/cphc.200700177.
- ^ 20.0 20.1 Tatsuo Hasegawa and Jun Takeya. Organic field-effect transistors using single crystals. Sci. Technol. Adv. Mater. 2009, 10 (2): 024314. Bibcode:2009STAdM..10b4314H. doi:10.1088/1468-6996/10/2/024314.
- ^ Yoshiro Yamashita. Organic semiconductors for organic field-effect transistors. Sci. Technol. Adv. Mater. 2009, 10 (2): 024313. Bibcode:2009STAdM..10b4313Y. doi:10.1088/1468-6996/10/2/024313.
外部链接
[编辑]- facts about pentacene (页面存档备份,存于互联网档案馆), retrieved Apr. 17, 2006
- Organic transistor improves with age (页面存档备份,存于互联网档案馆), New Scientist, 2 December 2007
- Pentacene Imaged (页面存档备份,存于互联网档案馆), IBM images Pentacene, the first molecule imaged in detail 29 August 2009
| ||||||||||||||||