氫氧化銅
| 氫氧化銅 | |
|---|---|

| |
| |
| IUPAC名 Copper(II) hydroxide | |
| 別名 | 氫氧化銅(II) |
| 識別 | |
| CAS號 | 20427-59-2 ? |
| PubChem | 164826 |
| 性質 | |
| 化學式 | Cu(OH)2 |
| 摩爾質量 | 97.561[1] g·mol⁻¹ |
| 外觀 | 藍色固體或藍綠色粉末[1] |
| 密度 | 3.368 g/cm3 (固) |
| 熔點 | 80 °C (分解成氧化銅) |
| 溶解性(水) | 難溶[1] |
| 溶度積Ksp | 2.20 × 10−20 [2] |
| 溶解性 | 不溶於乙醇; 溶於氨水、氰化鉀溶液、強鹼溶液中[1] |
| 危險性 | |
| MSDS | MSDS |
| 歐盟編號 | 未列出 |
| 主要危害 | 對皮膚,眼,呼吸系統具刺激性 |
| NFPA 704 | |
| 閃點 | 不可燃 |
| 致死量或濃度: | |
LD50(中位劑量)
|
1000 mg/kg (口服, 小鼠) |
| 相關物質 | |
| 其他陰離子 | 氧化銅 |
| 其他陽離子 | 氫氧化鎳 氫氧化鋅 |
| 相關化學品 | 氧化亞銅 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
氫氧化銅(化學式:Cu(OH)2)是金屬銅的氫氧化物。它是一種淡藍色固體,某些市售的氫氧化銅中混有一些碳酸銅,顏色偏綠。
歷史
[編輯]氫氧化銅自從熔銅開始就已經為人所知。公元前5000年的鍊金術士可能就已經知道氫氧化銅。[3]只需將藍礬和鹼液混合就可以製得氫氧化銅。
17和18世紀時出現了工業生產氫氧化銅,用於制顏料。[4] [5]
化學性質
[編輯]合成
[編輯]往硫酸銅溶液中滴入少許氫氧化鈉溶液即可。這樣的沉澱含有氫氧化鈉雜質,可以通過事先在溶液中加入氯化銨來避免。也可用電解法:陰極用銅,水中可加入一點電解質(如碳酸氫鈉)。純的氫氧化銅可由氫氧化鈉溶液與四氨合銅溶液混合形成。
銅在潮濕空氣中生成銅綠,是一種氫氧化銅和碳酸銅的1:1混合物。[6]
- 2Cu(s) + H2O(g) + CO2(g) + O2(g) Cu(OH)2·CuCO3(s)
鹼式碳酸銅(Cu(OH)2·CuCO3)就是某些銅合金表面的「鏽」。
反應
[編輯]- Cu(OH)2 CuO + H2O
氫氧化銅在乾燥時加熱到185 °C才會分解。[8]
氫氧化銅與氨水反應生成深藍色的銅氨溶液,含有[Cu(NH3)4]2+ 絡離子,但在稀釋後重新變成氫氧化銅。該銅氨溶液稱為Schweizer試劑,可以溶解纖維素。這使氫氧化銅可以用來生產人造絲。
氫氧化銅稍顯兩性,在濃鹼中生成深藍色[Cu(OH)4]2−離子。[9]
作為有機試劑
[編輯]氫氧化銅在有機合成中有重要作用。通常由銅鹽和氫氧化鉀生成並在原位反應。
氫氧化銅可以用來合成芳香胺,比如氫氧化銅可以催化乙二胺和1-溴蒽醌或1-氨基-4-溴蒽醌生成1-((2-氨基乙基)胺)蒽醌或1-氨基-4-((2-氨基乙基)氨基)蒽醌的反應。
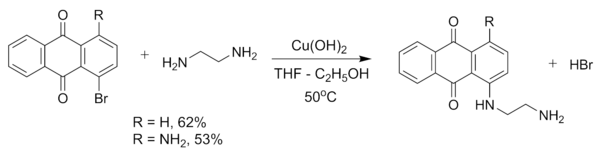
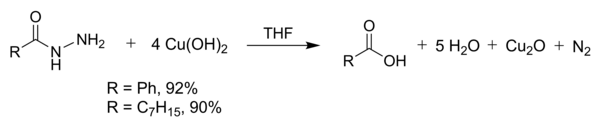
氫氧化銅可以在室溫下使酰肼轉化成羧酸。這可以用於合成一些帶有易反應官能團的羧酸。用此法製取苯甲酸和辛酸時產率較高。
此外,新制氫氧化銅(斐林試劑)可以在加熱條件下把醛氧化成羧酸,自身被還原為磚紅色氧化亞銅。此反應可以用來檢驗醛基或還原糖的存在。
天然存在形式
[編輯]氫氧化銅在多種礦物中存在,例如藍銅礦、孔雀石、塊銅礬和水膽礬。藍銅礦(2CuCO3·Cu(OH)2)和孔雀石(CuCO3·Cu(OH)2)屬於鹼式碳酸鹽,塊銅礬(CuSO4·2Cu(OH)2)和水膽礬(CuSO4·3Cu(OH)2)屬於鹼式硫酸鹽。氫氧化銅很少單獨存在,因為它很易分解,也會與空氣中的二氧化碳緩慢反應生成鹼式碳酸銅。單獨存在的礦物氫氧化銅稱為斯羥銅礦。
用途
[編輯]- 用於波爾多液(一種殺菌劑)的替代品。[10]由於環境污染問題,現已很少使用。
- 可用於瓷器上色。
- 用於乳膠漆,控制盆栽植物根的生長。它可以使次要的和邊上的根擴展,進而使植物根系發達。商品名Spin Out,最開始由Griffin L.L.C.引入。現所有權屬SePRO Corp.[11]
注意事項
[編輯]氫氧化銅對皮膚、眼、呼吸道有刺激性。使用氫氧化銅時應佩戴安全眼鏡。若不慎入眼,即用大量水清洗並就診。
參考資料
[編輯]- Roscoe, H. E., & Schorlemmer, C. (1879). A Treatise on Chemistry 2nd Ed, Vol 2, Part 2. MacMillan & Co. (p 498).
- Paquette, Leo A. (1995). Encyclopedia of Reagents for Organic Synthesis, 8 Volume Set. Wiley. ISBN 0-471-93623-5.
註釋
[編輯]- ^ 1.0 1.1 1.2 1.3 CRC Handbook of Chemistry and Physics 97th Edition. 2016-06-24: 4–60. ISBN 1-4987-5428-7 (英語).
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Richard Cowen, Essays on Geology, History, and People, Chapter 3: "Fire and Metals: Copper" (頁面存檔備份,存於互聯網檔案館).
- ^ Tony Johansen, Historic Artist's Pigments (頁面存檔備份,存於互聯網檔案館). PaintMaking.com. 2006.
- ^ Blue verditer 互聯網檔案館的存檔,存檔日期2007-09-27.. Natural Pigments. 2007.
- ^ Masterson, W. L., & Hurley, C. N. (2004). Chemistry: Principles and Reactions, 5th Ed. Thomson Learning, Inc. (p 331)"
- ^ Watts, Henry (1872). A Dictionary of Chemistry and the Allied Branches of Other Sciences, Vol 2. Longmans, Green, and Co. (p 69).
- ^ Copper (II) hydroxide 互聯網檔案館的存檔,存檔日期2007-09-28.. Ceramic Materials Database. 2003.
- ^ Pauling, Linus (1970). General Chemistry. Dover Publications, Inc. (p 702).
- ^ Bordeaux Mixture (頁面存檔備份,存於互聯網檔案館). UC IPM online. 2007.
- ^ "SePRO Corporation" (頁面存檔備份,存於互聯網檔案館).
| ||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


