足细胞
| 足细胞 | |
|---|---|
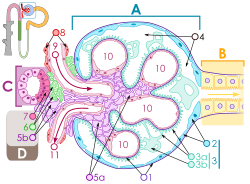 血液流动在入球小动脉(9)上端,及出球小动脉(11)下端。血液流过肾小球的毛细血管(10),它是通过压力过滤。足细胞(3a及3b,绿色)环绕在毛细管上。血液通滤过"裂隙膈膜"(或滤过裂隙),介于足细胞的足突或脚之间。过滤后的尿液通过了近曲小管(B,黄色)在右端. | |
 | |
| 基本信息 | |
| 发育自 | Intermediate mesoderm |
| 位置 | 肾的鲍氏囊 |
| 标识字符 | |
| 拉丁文 | podocytus |
| MeSH | D050199 |
| FMA | FMA:70967 |
| 《显微解剖学术语》 [在维基数据上编辑] | |
足细胞(podocyte、或"内脏上皮细胞"(visceral epithelial cell))为位于肾脏鲍氏囊上环绕着肾小球毛细血管之细胞。[1] 鲍氏囊过滤血液,阻碍大分子,如蛋白质、红血球、血小板;并通过小分子,如水、盐及糖,进一步形成尿液。
足细胞的长足突或"足突出部分"环绕着毛细血管,介于足突之间留有裂隙。血液滤过这些裂隙,每个裂隙称为裂隙隔膜(slit diaphragm)或滤过裂隙。足突出部分需要几种蛋白质(肾病蛋白、NEPH1、NEPH2、足蛋白、CD2AP)环绕着毛细管及运作。当婴儿出生时,这些蛋白质存在着一定的缺陷,诸如"肾病蛋白"及"CD2AP",使他们的肾脏不能正常的运作。人们的这些蛋白质存在著变异,以及某些变异在以后的生活中可能会使他们遗传倾向性的患有肾功能衰竭。肾病蛋白是一拉链状的蛋白、形成裂隙隔膜(滤过裂隙),在这些拉链的齿之间存有空间,足够大到允许糖和水通过,但又裂隙太小以至于不允许蛋白质(白蛋白)通过(防制水肿)。肾病蛋白缺陷对先天性肾功能衰竭负责。CD2AP调节足细胞细胞骨架构及稳定裂隙隔膜。[2][3]
结构
[编辑]
1: 过滤,2: 再吸收,3: 分泌,4: 尿排泄。
〈(尿排泄率)4)〉=〈过滤速度(1)−再吸收率(2)+分泌率(3)〉

(A).肾小球的内皮细胞(The endothelial cells of the glomerulus):
1.膜孔(fenestra)
(B).肾小球基底膜:
1.内层板(lamina rara interna)
2.致密层(lamina densa)
3.外层板(lamina rara externa)
(C).足细胞:
1.酵素及结构蛋白(enzymatic and structural protein)
2.滤过裂隙
3.膈膜(diaphragma/裂隙隔膜)
足细胞被发现存在于肾之肾单元鲍氏囊的内衬里。足细胞的延伸足突称为"足梗"(pedicel)、即由足细胞包覆自个儿且围绕著肾小球的毛细血管以形成滤过裂隙。足梗可以增加足细胞的表面积,从而实现有效的肾超滤(Ultrafiltration (renal))之作用。[4].
沿著足细胞的基底外侧区域有许多包被的囊泡和包被的凹坑,这表明出足细胞含有高比例的囊泡流量。
足细胞具有发育良好的内质网及大型的高尔基体,表现出蛋白质合成及翻译后修饰的大容量。
还有越来越多的证据表明,从这些细胞中可以观察到大量的多泡体和其他溶酶体的成分,表现出高度的内吞作用。
功能
[编辑]相邻的足细胞相互指向致覆盖与肾小球毛细血管密切相关的基底层。而足梗相互交错,并在它们之间留下间隙或薄的滤过裂隙。裂隙由裂隙隔膜所覆盖;裂隙是由许多细胞表面蛋白质、包括肾病蛋白、足糖萼蛋白以及钙粘蛋白所组成,如此限制了高分子诸如血清白蛋白及γ球蛋白的通过,并确保它们保留在血液中。[5]能让裂隙隔膜功能运作正确,所需的蛋白质包括肾病蛋白、[6]NEPH1、NEPH2、[7]足蛋白,以及CD2AP。[8]
小分子诸如水、葡萄糖以及离子盐能够通过"裂隙隔膜"并在管状流体中形成超滤作用,[9]且被肾单位进一步处理以产生尿液。
足细胞也涉入肾小球滤过率(GFR)的调节功能。当足细胞收缩时,它们会导致过滤过裂隙的闭合。借由减少可使用的过滤表表面积来降低GFR。
临床特性
[编辑]足细胞的足部行程的丧失(即足细胞消除)是微小病变的标志,因此有时被称为足部行程疾病。
过滤狭缝的破裂、或足细胞的破坏可导致大量蛋白尿的产生,其中大量的蛋白质会从血液中流失。
这种情况发生在先天性疾病芬兰型先天性肾病综合症,其特征在于新生儿蛋白尿将导致末期的肾功能衰竭。这种疾病已经被发现是由于肾病蛋白基因的突变所引起的。
注释
[编辑]- ^ 道兰氏医学词典中的Podocyte
- ^ First components found for key kidney filter, Ingrid Wickelgren, Science, 8 October 1999, 286:225
- ^ M. M. Löwik, P. J. Groenen, E. N. Levtchenko, L. A. Monnens, L. P. van den Heuvel. Molecular genetic analysis of podocyte genes in focal segmental glomerulosclerosis--a review. European Journal of Pediatrics. 2009-11, 168 (11): 1291–1304 [2019-02-12]. ISSN 1432-1076. PMC 2745545
 . PMID 19562370. doi:10.1007/s00431-009-1017-x. (原始内容存档于2019-09-13).
. PMID 19562370. doi:10.1007/s00431-009-1017-x. (原始内容存档于2019-09-13).
- ^ MCG生理学 7/7ch04/7ch04p08
- ^ Jarad, G.; Miner, J. H. Update on the glomerular filtration barrier. Current Opinion in Nephrology and Hypertension. 2009, 18 (3): 226–232. PMC 2895306
 . PMID 19374010. doi:10.1097/mnh.0b013e3283296044.
. PMID 19374010. doi:10.1097/mnh.0b013e3283296044.
- ^ Wartiovaara, J.; Ofverstedt, L. G. R.; Khoshnoodi, J.; Zhang, J.; Mäkelä, E.; Sandin, S.; Ruotsalainen, V.; Cheng, R. H.; Jalanko, H.; Skoglund, U.; Tryggvason, K. Nephrin strands contribute to a porous slit diaphragm scaffold as revealed by electron tomography. Journal of Clinical Investigation. 2004, 114 (10): 1475–1483. PMC 525744
 . PMID 15545998. doi:10.1172/JCI22562.
. PMID 15545998. doi:10.1172/JCI22562.
- ^ Neumann-Haefelin, E.; Kramer-Zucker, A.; Slanchev, K.; Hartleben, B.; Noutsou, F.; Martin, K.; Wanner, N.; Ritter, A.; Gödel, M.; Pagel, P.; Fu, X.; Müller, A.; Baumeister, R.; Walz, G.; Huber, T. B. A model organism approach: Defining the role of Neph proteins as regulators of neuron and kidney morphogenesis. Human Molecular Genetics. 2010, 19 (12): 2347–2359. PMID 20233749. doi:10.1093/hmg/ddq108.
- ^ Fukasawa, H.; Bornheimer, S.; Kudlicka, K.; Farquhar, M. G. Slit Diaphragms Contain Tight Junction Proteins. Journal of the American Society of Nephrology. 2009, 20 (7): 1491–1503. PMC 2709684
 . PMID 19478094. doi:10.1681/ASN.2008101117.
. PMID 19478094. doi:10.1681/ASN.2008101117.
- ^ eMedicine Dictionary上的Podocyte Podocyte
参见
[编辑]外部链接
[编辑]- Organology at UC Davis Urinary/mammal/vasc1/vasc1 - "Mammal, renal vasculature (EM, High)
- Histology image: 22401loa – 波士顿大学的组织学学习系统 - ". Ultrastructure of the Cell: podocytes and glomerular capillaries"
- UIUC组织学主题 1400
- podocyte.ca[失效链接] at Lunenfeld-Tanenbaum Research Institute
- MCG生理学 7/7ch04/7ch04p09
- Histology image: 22402loa – 波士顿大学的组织学学习系统
- Histology image: 22403loa – 波士顿大学的组织学学习系统
| ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
