香芹酮
| 香芹酮 | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 2-Methyl-5-(prop-1-en-2-yl)cyclohex-2-en-1-one | |||
| 英文名 | Carvone | ||
| 识别 | |||
| CAS号 | 99-49-0(R/S) 6485-40-1(R) 2244-16-8(S) | ||
| PubChem | 7439 | ||
| ChemSpider | 21106424 (R/S), 15855 (S), 388655 (R) | ||
| InChI |
| ||
| InChIKey | ULDHMXUKGWMISQ-UHFFFAOYAB | ||
| ChEBI | 38265 | ||
| RTECS | OS8650000 (R) OS8670000 (S) | ||
| KEGG | C01767 | ||
| 性质 | |||
| 化学式 | C10H14O | ||
| 摩尔质量 | 150.22 g·mol⁻¹ | ||
| 外观 | 无色清澈液体 | ||
| 密度 | 0.96 g/cm3 | ||
| 熔点 | 25.2 °C(298 K) | ||
| 沸点 | 231 °C(504 K)(91 °C @ 5 mmHg) | ||
| 溶解性(水) | 不溶于冷水 微溶于热水 | ||
| 溶解性(乙醇) | 可溶 | ||
| 溶解性(乙醚) | 可溶 | ||
| 溶解性(氯仿) | 可溶 | ||
| [α]20 D |
−61°(R) 61°(S) | ||
| 磁化率 | −92.2×10−6 cm3/mol | ||
| 危险性 | |||
GHS危险性符号  
| |||
| GHS提示词 | Danger | ||
| H-术语 | H304, H315, H317, H411 | ||
| P-术语 | P261, P264, P270, P272, P273, P280, P301+310, P301+312, P302+352, P321, P330, P331, P332+313, P333+313 | ||
| 主要危害 | 可燃 | ||
| NFPA 704 | |||
| 相关物质 | |||
| 相关酮 | 薄荷酮 二氢香芹酮 | ||
| 相关化学品 | 柠烯 薄荷醇, 对异丙基甲苯 香芹醇 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
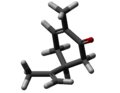
香芹酮(英語:Carvone)是一种单萜类有机化合物,分子式为C10H14O[1]。香芹酮是浅橙色至浅棕色油狀液體,可溶於氯仿、甲醇。[2]香芹酮是许多精油中的天然产物,但在葛縷子(Carum carvi)、留蘭香(Mentha spicata)、蒔蘿(Anethum graveolens)的种子油中含量最丰富[3]。
歷史
[编辑]古羅馬人已將葛縷子入藥[4]。然而,直到1849年,香芹酮才被Franz Varrentrapp (1815–1877) 分離。[5][6] Goldschmidt 和 Zürrer 確定香芹酮為與檸檬烯相關的酮[7],而香芹酮的結構最終由俄羅斯有機化學家葉戈爾·華格納提出[8]。
立體化學
[编辑]
香芹酮由兩個鏡像異構體:賦予薄荷微甜薄荷味的R-(−)-香芹酮,以及其鏡像,即賦予葛縷子籽辛辣氣味的S-(+)-香芹酮。[9][10]
兩個對映異構體被感知味氣味不同說明,嗅覺受體對兩個異構體的反應不一。研究發現松鼠猴亦能分辨出香芹酮兩個對映體的氣味。[11]
天然存在
[编辑]S-(+)-香芹酮是葛縷子油的主要成分(60-70%)[12],而葛縷子油一年的產量達到大約10噸[13]。它占蒔蘿籽油的40-60%,亦存在於橘子皮。
R-(-)-香芹酮是數個薄荷品種的精油的主要成分,尤其是留蘭香油(50-80%)[14],因此留蘭香油是天然R-(-)-香芹酮的主要天然來源之一。然而,大部分的商用R-(-)-香芹酮是由R-(+)-檸檬烯製備而成。[15]
而某些精油,例如鲁沙香茅油,則同時含有以上兩個對映異構體。
應用
[编辑]食品
[编辑]香芹酮的兩個對映異構體均應用於食品工業。香芹酮是葛縷子、蒔蘿和留蘭香等香料的主要香氣成分,而這些香料長久以來都應用於製備食物。[16]同時,R-(-)-香芹酮被用作食用香精。[2]
害蟲防治
[编辑]合成
[编辑]香芹酮可以由檸檬烯合成。先將檸檬烯與亞硝酰氯反應,加熱所生成的亞硝基化合物會產生香芹酮肟,再將其與草酸反應,則能合成香芹酮。[18]
作為製造橙汁的副產物,橙皮的供應量龐大,因此可以廉價獲得檸檬烯,相應地讓合成香芹酮的成本變得較低。[19]
生物合成
[编辑]在薄荷[20]、葛縷子[21]等植物中,香芹酮是由檸檬烯氧化而成。
化學性質
[编辑]還原
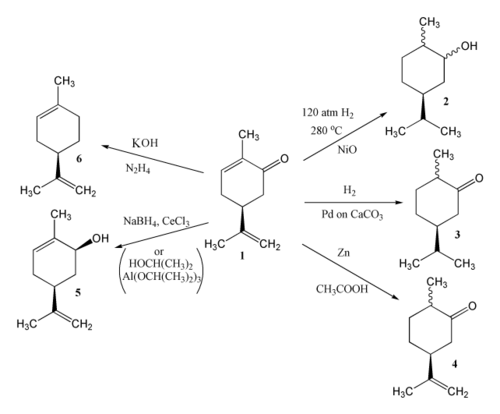
[编辑]香芹酮分子中共有三個雙鍵可以被還原,反應的產物取決於反應的試劑與條件。[1]催化氫化可以生成香芹薄荷醇(2)或香芹薄荷酮(3),以鋅/乙酸還原可以生成二氫香芹酮(4),MPV还原反应或Luche还原反应生成香芹醇(5),而沃尔夫-凯惜纳-黄鸣龙还原反应反應生成檸檬烯。
氧化
[编辑]
共軛加成
[编辑]作為 α,β-不飽和酮,香芹酮能夠與親核試劑進行共軛加成。例如,香芹酮能夠與二甲基銅鋰反應在3-位甲基化,產物中异丙烯基與甲基為反式關係,反應選擇性好;隨後再與烯丙基溴反應引入烯丙基,生成產物(11)。[22]

全合成的應用
[编辑]由於純手性的香芹酮可以廉價獲得,香芹酮是不對稱天然產物全合成優秀的起始物。例如,在1998年,(S)-(+)-香芹酮被用於苦木素全合成的起始物[23]:
又例如,塞缪尔·丹尼谢夫斯基对天然产物Peribysin E(一种艾里莫芬烷类倍半萜[24])的全合成,就是以香芹酮和3-三甲基硅氧基-1,3-丁二烯经过D-A反应得到的产物为起始物來實現的。[25]

其他
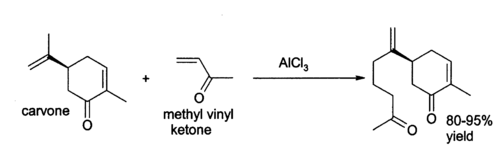
[编辑]香芹酮的雙鍵可以參與Ene反應,比如與3-丁烯-2-酮加成:[26]
代謝
[编辑]體內研究顯示香芹酮主要在身體內代謝成香芹酮酸、二氫香芹酮酸和uroterpenolone。[27]副產物(−)-或(+)-香芹醇分別是(−)-或(+)-香芹酮被NADPH還原而生。[28]這過程主要發生在肝臟,而且涉及到细胞色素P450氧化酶和(+)-反式香芹酚脱氫酶。
参考文献
[编辑]- ^ 1.0 1.1 1.2 Simonsen, J. L. The Terpenes 1 2nd. Cambridge: Cambridge University Press. 1953: 394–408.
- ^ 2.0 2.1 香芹酮. ChemicalBook. [2025-07-30] (中文).
- ^ de Carvalho, Carla C. C. R.; da Fonseca, M. Manuela R. Carvone: Why and how should one bother to produce this terpene. Food Chemistry. 2006-04-01, 95 (3): 413-422. ISSN 0308-8146. doi:10.1016/j.foodchem.2005.01.003.
- ^ De Carvalho, C. C. C. R.; Da Fonseca, M. M. R. Carvone: Why and how should one bother to produce this terpene. Food Chemistry. 2006, 95 (3): 413–422. doi:10.1016/j.foodchem.2005.01.003.
- ^ Simonsen, J. L. The Terpenes 1 2nd. Cambridge: Cambridge University Press. 1953: 394–408.
- ^ Handwörterbuch der reinen und angewandten Chemie [Concise dictionary of pure and applied chemistry] (Braunschweig, (Germany): Friedrich Vieweg und Sohn, 1849), vol. 4, pages 686-688. [備註: (1) Varrentrapp 將葛縷子油和飽和硫化氫與氨的酒精溶液,反應產生晶狀沉澱。往沉澱加入氫氧化鉀的酒精溶液,然後再加水,可以獲得香芹酮。(2) Varrentrapp 使用的原子質量是不正確的(例如碳的原子質量為6而飛正確的12),因此所列的香芹酮的實驗式是不正確的
- ^ Heinrich Goldschmidt and Robert Zürrer (1885) "Ueber das Carvoxim," Berichte der Deutschen Chemischen Gesellschaft, 18 : 1729–1733.
- ^ Georg Wagner (1894) "Zur Oxydation cyklischer Verbindungen" (On the oxidation of cyclic compounds), Berichte der Deutschen chemischen Gesellschaft zu Berlin, vol. 27, pages 2270-2276.
- ^ Theodore J. Leitereg; Dante G. Guadagni; Jean Harris; Thomas R. Mon; Roy Teranishi. Chemical and sensory data supporting the difference between the odors of the enantiomeric carvones. J. Agric. Food Chem. 1971, 19 (4): 785–787. doi:10.1021/jf60176a035.
- ^ Morcia, Caterina; Tumino, Giorgio; Ghizzoni, Roberta; Terzi, Valeria. Carvone (Mentha spicata L.) Oils - Essential Oils in Food Preservation, Flavor and Safety - Chapter 35. Essential Oils in Food Preservation, Flavor and Safety. 2016: 309–316. doi:10.1016/B978-0-12-416641-7.00035-3.
- ^ Laska, M.; Liesen, A.; Teubner, P. Enantioselectivity of odor perception in squirrel monkeys and humans. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 1999, 277 (4): R1098–R1103. PMID 10516250. doi:10.1152/ajpregu.1999.277.4.r1098.
- ^ Hornok, L. Cultivation and Processing of Medicinal Plants, John Wiley & Sons, Chichester, UK, 1992.
- ^ De Carvalho, C. C. C. R.; Da Fonseca, M. M. R. Carvone: Why and how should one bother to produce this terpene. Food Chemistry. 2006, 95 (3): 413–422. doi:10.1016/j.foodchem.2005.01.003.
- ^ [1] 互联网档案馆的存檔,存档日期2012-04-10., Chemical composition of essential oil from several species of mint (Mentha spp.)
- ^ Fahlbusch, Karl-Georg; Hammerschmidt, Franz-Josef; Panten, Johannes; Pickenhagen, Wilhelm; Schatkowski, Dietmar; Bauer, Kurt; Garbe, Dorothea; Surburg, Horst. Flavors and Fragrances. Ullmann's Encyclopedia of Industrial Chemistry. 2003. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a11_141.
- ^ De Carvalho, C. C. C. R.; Da Fonseca, M. M. R. Carvone: Why and how should one bother to produce this terpene. Food Chemistry. 2006, 95 (3): 413–422. doi:10.1016/j.foodchem.2005.01.003.
- ^ Document Display (PURL) | NSCEP | US EPA. nepis.epa.gov. [2020-11-10].
- ^ Rothenberger, Otis S.; Krasnoff, Stuart B.; Rollins, Ronald B. Conversion of (+)-Limonene to (−)-Carvone: An organic laboratory sequence of local interest. Journal of Chemical Education. 1980, 57 (10): 741. Bibcode:1980JChEd..57..741R. doi:10.1021/ed057p741.
- ^ Karl-Georg Fahlbusch, Franz-Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg "Flavors and Fragrances" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim doi:10.1002/14356007.a11_141
- ^ Akhila, Anand; Derek, Derek V.; Mi, Michael G. Biosynthesis of carvone in Mentha spicata. Phytochemistry. 1980, 19 (7): 1433-1437 [2025-07-30]. doi:10.1016/0031-9422(80)80189-0.
- ^ Bouwmeester, Harro J.; Gershenzon, Jonathan; Konings, Maurice CJM; Croteau, Rodney. Biosynthesis of the Monoterpenes Limonene and Carvone in the Fruit of Caraway. Plant Physiol. 1998, 117 (3): 901–912 [2025-07-30]. doi:10.1104/pp.117.3.901.
- ^ Srikrishna, A.; Jagadeeswar Reddy, T. Enantiospecific synthesis of (+)-(1S, 2R, 6S)-1, 2-dimethylbicyclo [4.3. 0] nonan-8-one and (−)-7-epibakkenolide-A. Tetrahedron. 1998, 54 (38): 11517–11524. doi:10.1016/S0040-4020(98)00672-3.
- ^ (a) Shing, T. K. M.; Jiang, Q; Mak, T. C. W. J. Org. Chem. 1998, 63, 2056-2057. (b) Shing, T. K. M.; Tang, Y. J. Chem. Soc. Perkin Trans. 1 1994, 1625
- ^ Takeshi Yamada, Masashi Iritani, Katsuhiko Minoura, Kenzo Kawai and Atsushi Numata. Peribysins A–D, potent cell-adhesion inhibitors from a sea hare-derived culture of Periconia species. Org. Biomol. Chem. 2004, (2): 2131–2135 [2012-08-30]. doi:10.1039/B404459B. (原始内容存档于2016-12-22).
- ^ Angeles, A. R.; Waters, S. P.; Danishefsky, S. J. Total Syntheses of (+)- and (−)-Peribysin E. Journal of the American Chemical Society. 2008, 130: 13765 [2012-08-20]. doi:10.1021/ja8048207. (原始内容存档于2021-10-18).
- ^ B. B. Snider, Accounts of Chemical Research 13, 426 (1980).
- ^ Engel, W. In vivo studies on the metabolism of the monoterpenes S-(+)- and R-(−)-carvone in humans using the metabolism of ingestion-correlated amounts (MICA) approach. J. Agric. Food Chem. 2001, 49 (8): 4069–4075. PMID 11513712. doi:10.1021/jf010157q.
- ^ Jager, W.; Mayer, M.; Platzer, P.; Reznicek, G.; Dietrich, H.; Buchbauer, G. Stereoselective metabolism of the monoterpene carvone by rat and human liver microsomes. Journal of Pharmacy and Pharmacology. 2000, 52 (2): 191–197. PMID 10714949. S2CID 41116690. doi:10.1211/0022357001773841
 .
.
| 这是一篇关于有机化合物的小作品。您可以通过编辑或修订扩充其内容。 |