连二亚硫酸钠
| 連二亞硫酸鈉 | |
|---|---|
| |

| |

| |
| 别名 | 低亞硫酸鈉 二硫亞磺酸鈉 亞硫酸氫鈉 保險粉 |
| 识别 | |
| CAS号 | 7775-14-6 |
| PubChem | 24489 |
| ChemSpider | 22897 |
| SMILES |
|
| UN编号 | 1384 |
| EINECS | 231-890-0 |
| ChEBI | 66870 |
| RTECS | JP2100000 |
| 性质 | |
| 化学式 | Na2S2O4 |
| 摩尔质量 | (無水)174.107 g/mol (二水)210.146 g·mol⁻¹ |
| 外观 | 白色至淺灰色結晶粉末 淺檸檬色薄片 |
| 氣味 | 淡硫磺味 |
| 密度 | 2.38 g/cm3 (無水) 1.58 g/cm3(二水) |
| 熔点 | 52 °C(325 K) |
| 沸点 | 分解 |
| 溶解性(水) | 18.2 g/100 mL(無水,20 °C) 21.9 g/100 mL(二水,20 °C) |
| 溶解性 | 微溶於醇 |
| 危险性 | |
GHS危险性符号 
| |
| GHS提示词 | Danger |
| H-术语 | H251, H302 |
| P-术语 | P235+410, P264, P270, P280, P301+312, P330, P407, P413, P420, P501 |
| NFPA 704 | |
| 相关物质 | |
| 其他阴离子 | 亞硫酸鈉 硫酸鈉 |
| 相关化学品 | 硫代硫酸鈉 亞硫酸氫鈉 焦亞硫酸鈉 硫酸氫鈉 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
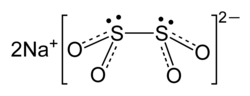
連二亞硫酸鈉(英語:sodium dithionite),又稱二硫亞硫酸鈉[1]、低亚硫酸钠(英語:sodium hydrosulfite),俗稱保险粉,化學式為Na2S2O4,是白色結晶粉末,有硫磺氣味。在乾燥空氣中穩定,在熱水和酸溶液中分解。
結構
[编辑]結構已通過拉曼光譜和單晶X射線衍射進行檢查。連二亞硫酸根離子有C2對稱群,有16°的O-S-S-O扭轉角。二水合物(Na
2S
2O
4·2H
2O)的連二亞硫酸根陰離子具有約56°的O-S-S-O扭轉角。[2]
弱S-S鍵的S-S距離239pm,相對於典型的S-S鍵被延長了30pm。[3]由於這種鍵很脆弱,連二亞硫酸鹽陰離子在溶液中解離成[SO2]−自由基,已被EPR光譜證實。還觀察到在中性或酸性溶液中,35S在S2O42−和SO2之間快速交換,與陰離子中的弱S-S鍵一致。[4]
製備
[编辑]連二亞硫酸鈉在工業上通過還原二氧化硫生產。1990年生產了大約300000噸。[5]
使用鋅粉法為兩步過程:
- 2 SO2 + Zn = ZnS2O4
- ZnS2O4 + 2 NaOH = Na2S2O4 + Zn(OH)2
使用甲酸鈉法製備:
- HCOONa + NaOH + 2 SO2 = Na2S2O4 + CO2 + H2O
使用硼氫化鈉法製備:
- NaBH4 + 8 NaOH + 8 SO2 = 4 Na2S2O4 + NaBO2 + 6 H2O
每份H−還原兩份二氧化硫。甲酸鹽也可被用作還原劑。
性質和反應
[编辑]水解
[编辑]連二亞硫酸鈉乾燥時穩定,但水溶液由於以下反應而變質:
- 2 S2O42− + H2O = S2O32− + 2 HSO3−
這是由於連二亞硫酸的不穩定性導致的。因此連二亞硫酸鈉溶液不能長期儲存。[4]
無水連二亞硫酸鈉在空氣中90°C以上會分解成硫酸鈉和二氧化硫。沒有空氣的情況下,在150°C以上會迅速分解為亞硫酸鈉、硫代硫酸鈉、二氧化硫和微量硫。
氧化還原反應
[编辑]連二亞硫酸鈉是一種還原劑。在pH為7時,與標準氫電極相比,電位為-0.66V。氧化還原隨著亞硫酸氫鹽的形成而發生:[6]
- S2O42- + 2 H2O = 2 HSO3− + 2 e− + 2 H+
連二亞硫酸鈉與氧氣反應:
- Na2S2O4 + O2 + H2O = NaHSO4 + NaHSO3
這些反應表現出複雜的pH依賴性平衡,包括亞硫酸氫鹽、硫代硫酸鹽和二氧化硫。
有機反應
[编辑]在醛的存在下,連二亞硫酸鈉在室溫下反應形成 α-羥基亞磺酸鹽,或者在85°C以上溫度下將醛還原為相應的醇。[7][8]一些酮也在類似條件下被還原。
應用
[编辑]由於是水溶性的,連二亞硫酸鈉在一些工業染色過程中用作還原劑。在硫化染料和還原染料的情況下,不溶於水的染料可以還原成水溶性鹼金屬鹽(如靛藍)。[9]
安全性
[编辑]連二亞硫酸鈉的廣泛使用部分歸於其低毒性,LD50為2.5g/kg(大鼠,口服)。[5]
參見
[编辑]參考資料
[编辑]- ^ 存档副本. [2022-10-26]. (原始内容存档于2022-10-26).
- ^ Weinrach, J. B.; Meyer, D. R.; Guy, J. T.; Michalski, P. E.; Carter, K. L.; Grubisha, D. S.; Bennett, D. W. A structural study of sodium dithionite and its ephemeral dihydrate: A new conformation for the dithionite ion. Journal of Crystallographic and Spectroscopic Research. 1992, 22 (3): 291–301. S2CID 97124638. doi:10.1007/BF01199531.
- ^ Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- ^ 4.0 4.1 Catherine E. Housecroft; Alan G. Sharpe. Chapter 16: The group 16 elements. Inorganic Chemistry, 3rd Edition. Pearson. 2008: 520. ISBN 978-0-13-175553-6.
- ^ 5.0 5.1 José Jiménez Barberá; Adolf Metzger; Manfred Wolf. Sulfites, Thiosulfates, and Dithionites. Ullmann's Encyclopedia of Industrial Chemistry. Wiley Online Library. 15 June 2000. ISBN 978-3527306732. doi:10.1002/14356007.a25_477.
- ^ Mayhew, S. G. The Redox Potential of Dithionite and SO−2 from Equilibrium Reactions with Flavodoxins, Methyl Viologen and Hydrogen plus Hydrogenase. European Journal of Biochemistry. 2008, 85 (2): 535–547. PMID 648533. doi:10.1111/j.1432-1033.1978.tb12269.x
 .
.
- ^ J. Org. Chem., 1980, 45 (21), pp 4126–4129, http://pubs.acs.org/doi/abs/10.1021/jo01309a011 (页面存档备份,存于互联网档案馆)
- ^ Aldehyde sulfoxylate systemic fungicides. google.com. [27 April 2018]. (原始内容存档于27 April 2018).
- ^ Božič, Mojca; Kokol, Vanja. Ecological alternatives to the reduction and oxidation processes in dyeing with vat and sulphur dyes. Dyes and Pigments. 2008, 76 (2): 299–309. doi:10.1016/j.dyepig.2006.05.041.

