水電解
外观
(重定向自水电解)

水電解是指以電流通過水以製造氫氣與氧氣。此電解的最低電壓限制為1.23伏特。[1]
這個工序可製作氫燃料和醫療氧氣,但由於成本問題,大部分人均以天然氣製作氫氣,並從空氣中提取氧氣。
歷史
[编辑]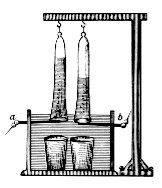
1789年,荷蘭發明家首次成功以莱顿瓶盛水發電。[2] 1800年,亞歷山德羅·伏打研發伏打電堆。僅僅數星期後,威廉·聶歌遜和安東尼·卡萊爾便以此成功進行水電解。齐纳布·格拉姆在1869年發明了格拉姆機後,水電解成為一個低成本的氫氣生產方法。1888年,水電解在工業中被採用。[3]
原理
[编辑]將兩個以鉑或不銹鋼或銥等金屬製造的惰性電極接到直流電上,放到水中。[4]
在外加电压的作用下,氫氣會從陰極冒出,而氧氣則會從陽極冒出。理論上如果沒有任何其他化學反應,生成的氫氣量應是氧氣量的2倍。 然而,實際上由於水中有雜質,这些雜質被電解的副反应会生成副產品,使得所產生的氫氣或氧氣少于理论值。[5]
純水電解則需要更多能量。純水因為缺乏具有导电性的離子,導電性能極差,只有海水約百萬分之一。大部分電解器材亦沒有任何電解催化劑,只能依靠電解質以增加導電性能。
现在,由于水電解的所有產品均可以通过更低成本的途径得到,水電解在工业中暂时没有应用。
化學式
[编辑]
陰極還原反應︰ 2 H+(aq) + 2 e- → H2[6]
陽極氧化反應︰ 4 OH- → 2 H2O + O2 + 4e-[6]
由上列化學式可見,氫分子的數量是氧分子的2倍,若温度、氣壓等一樣,體積亦為其2倍。
參考
[编辑]- ^ Spark Notes[失效連結]
- ^ Levie, R. de. The electrolysis of water. Journal of Electroanalytical Chemistry. October 1999, 476 (1): 92–93 [30 December 2009]. doi:10.1016/S0022-0728(99)00365-4. (原始内容存档于2019-01-07).
- ^ Lachinov Dmitry Aleksandrovich 互联网档案馆的存檔,存档日期26 July 2011. at Great Cyrill and Methodius Encyclopedia (俄文)
- ^ Zumdahl, Steven S.; Zumdahl, Susan A. Chemistry. Ninth edition. Belmont, CA: Brooks/Cole, Cengage Learning. 2014. ISBN 978-1-133-61109-7. 缺少或
|title=为空 (帮助) - ^ Electrolysis of Water - Energy Foundations for High School Chemistry. highschoolenergy.acs.org. [2017-07-08]. (原始内容存档于2017-06-27).
- ^ 6.0 6.1 Hydrogen Production: Electrolysis - Department of Energy. energy.gov. [2017-07-08]. (原始内容存档于2017-06-30).
