失水反应
失水反应(英語:dehydration reaction),也称脱水反应,是消除反应的一类,反应中反应物发生脫去水的化学反应。加速失水反应进行的化学试剂一般称为失水剂。醇失水成烯或醚的反应是常见的失水反应之一,反应通常需要借助布朗斯特酸催化,以使不好的离去基团羟基(-OH)转化为易离去的水(-OH2+)。
脫水反應可成為化工生產中其中一道单元过程。脫水反應是水合的逆过程,把水分子从物质分子中解脱出来。对于单纯的水合物来说,比较容易,一般只要加热使水脱离蒸发就可以了,如将碳酸钠水合物晶体加热,就会脱水成为碳酸钠粉末。倘若抽出水份子後,原分子會成为新化合物的話,脱水就必须借助催化剂或控制其他条件,如将乙醇脱水制成乙烯或乙醚等。
脫水反應的經典例子是費歇爾酯化反應,其中涉及用醇處理羧酸以生成酯
- RCO2H + R′OH ⇌ RCO2R′ + H2O
此類反應通常需要脫水劑(即與水發生反應的物質)的存在。
醚化反應
[编辑]- 2 R-OH → R-O-R + H2O
兩個單醣,例如葡萄糖和果糖,可以透過脫水合成結合在一起(形成蔗糖)。由兩個單醣組成的新分子稱為雙醣。
腈的形成
[编辑]腈類通常由一級酰胺脫水製備。
酰胺失水成腈:
- RCONH2 → R-CN + H2O
透過加熱乙酸並捕獲產物可生成乙烯酮[1]:
- CH3CO2H → CH2=C=O + H2O
烯烴的形成
[编辑]烯烴可以由醇脫水製成。醇失水成烯[2]:
- R-CH2-CHOH-R → R-CH=CH-R + H2O
這種轉化可用於將生物質轉化為液體燃料[3]。 乙醇轉化為乙烯是一個基本例子[4][5]:
- CH3CH2OH → H2C=CH2 + H2O
硫酸和某些沸石等酸性催化劑可加速此反應。這些反應通常透過碳正離子中間體進行,如環己醇脫水反應所示。[6]
有些醇類容易發生脫水反應。 3-羥基羰基,稱為羥基醛,在室溫下放置時會釋放水:
- RC(O)CH2CH(OH)R' → RC(O)CH=CHR' + H2O
此反應是由脫水試劑引起的。例如,2-甲基環己-1-醇在馬丁硫烷存在下脫水生成1-甲基環己烯,後者與水不可逆反應[7][8]
其他反應
[编辑]- 2 RCO2H → (RCO)2O + H2O
- C12H22O11 + 98% H2SO4 → 12 C (石墨粉) + 11 H2O(g) + 硫酸/水混合物
浓硫酸与水发生强烈放热反应,推动了上述反应进行。
各種建築材料都是透過脫水生產的。熟石膏是由石膏在窯中脫水而生成的[14][15]:
- 熱 (以蒸氣形式釋放).
將所得的乾粉與水混合,就可形成堅硬但可操作的硬化糊狀物。
参见
[编辑]参考资料
[编辑]- ^ Miller, Raimund; Abaecherli, Claudio; Said, Adel; Jackson, Barry, Ketenes, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a15_063
- ^ Dehydration of 2-Methyl-1-cyclohexanol: New Findings from a Popular Undergraduate Laboratory Experiment J. Brent Friesen and Robert Schretzman J. Chem. Educ., 2011, 88 (8), pp 1141–1147 doi:10.1021/ed900049b
- ^ Besson, Michèle; Gallezot, Pierre; Pinel, Catherine. Conversion of Biomass into Chemicals over Metal Catalysts. Chemical Reviews. 2014-02-12, 114 (3): 1827–1870 [2025-03-09]. ISSN 0009-2665. PMID 24083630. doi:10.1021/cr4002269. (原始内容存档于2024-04-20) (英语).
- ^ Zimmermann, Heinz; Walz, Roland. Ethylene. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2008. ISBN 978-3527306732. doi:10.1002/14356007.a10_045.pub3.
- ^ Zhang, Minhua; Yu, Yingzhe. Dehydration of Ethanol to Ethylene. Industrial & Engineering Chemistry Research. 2013-07-17, 52 (28): 9505–9514 [2025-03-09]. ISSN 0888-5885. doi:10.1021/ie401157c. (原始内容存档于2024-04-20) (英语).
- ^ G. H. Coleman, H. F. Johnstone. Cyclohexene. Organic Syntheses. 1925, 5: 33. doi:10.15227/orgsyn.005.0033.
- ^ J. Brent Friesen; Robert Schretzman. Dehydration of 2-Methyl-1-cyclohexanol: New Findings from a Popular Undergraduate Laboratory Experiment. J. Chem. Educ. 2011, 88 (8): 1141–1147. Bibcode:2011JChEd..88.1141F. doi:10.1021/ed900049b.
- ^ Roden, Brian A. Diphenylbis(1,1,1,3,3,3-hexafluoro-2-phenyl-2-propoxy)sulfurane. Encyclopedia of Reagents for Organic Synthesis. 2001. ISBN 0471936235. doi:10.1002/047084289X.rd409.
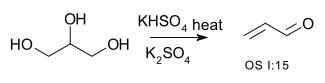
- ^ (1926) "Acrolein". Org. Synth. 6.
- ^ Katryniok, Benjamin; Paul, Sébastien; Bellière-Baca, Virginie; Rey, Patrick; Dumeignil, Franck. Glycerol dehydration to acrolein in the context of new uses of glycerol. Green Chemistry. 2010, 12 (12): 2079. ISSN 1463-9262. doi:10.1039/c0gc00307g (英语).
- ^ Margaret Jevnik Gentles, Jane B. Moss, Hershel L. Herzog, and E. B. Hershberg. The Dienol-Benzene Rearrangement. Some Chemistry of 1,4-Androstadiene-3,17-dione. J. Am. Chem. Soc. 1958, 80 (14): 3702 – 3705. doi:10.1021/ja01547a058.
- ^ H. Plieninger and Gunda Keilich. Die Dienol-Benzol-Umlagerung. Angew. Chem. 1956, 68 (19): 618–618. doi:10.1002/ange.19560681914.
- ^ Margaret Jevnik Gentles, Jane B. Moss, Hershel L. Herzog, and E. B. Hershberg. The Dienol-Benzene Rearrangement. Some Chemistry of 1,4-Androstadiene-3,17-dione. J. Am. Chem. Soc. 1958, 80 (14): 3702–3705. doi:10.1021/ja01547a058.
- ^ Franz Wirsching "Calcium Sulfate" in Ullmann's Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH, Weinheim. doi:10.1002/14356007.a04_555
- ^ Staff. CaSO4, ½ H2O. LaFargePrestia. [27 November 2008]. (原始内容存档于November 20, 2008).